
| 指示剂 | a | b | c |
| 变色pH范围 | 3.1~4.4 | 8.0~10.0 | 4.4~6.2 |
| 说明 | pH<3.1显红色 pH>4.4显黄色 | pH<8.0显无色 pH>10.0显红色 | pH<4.4显红色 pH>6.2显黄色 |

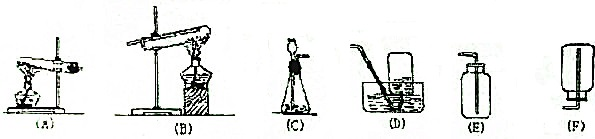
分析 (1)①由于碳化钙极易与水反应,因此U形管中有关盛放固体干燥剂防止水蒸气进入,因此可以是碱石灰或无水氯化钙等;
②由于普通玻璃中含有二氧化硅,而在高温下二氧化硅能与碳酸钙反应生成硅酸钙和CO2,所以不能用普通玻璃管代替图中石英管;
(2)由于过量的碳化钙也能与水反应产生气泡,因此要验证含有氮元素,还必须检验生成的气体中含有氨气,所以正确的操作是将湿润的红色石蕊试纸置于容器口,试纸变蓝色,说明固体中含有氮元素;
(3)①滴定前溶液显酸性,而b指示剂在酸性条件下是无色的,当硫酸恰好被反应后,硫酸铵溶液还是显酸性的,因此如果用b指示剂,溶液仍然是无色的,因此不宜选用的是b;
②样品中有碳化钙,碳化钙能与水反应生成乙炔和氢氧化钙,消耗氢氧化钠的物质的量是0.001cvmol,则根据反应式2NaOH+H2SO4=Na2SO4+2H2O可知剩余硫酸的物质的量是0.0005cvmol×$\frac{200mL}{20mL}$=0.005cvmol,所以与氨气反应的硫酸的物质的量是0.02mol-0.005cvmol,则与硫酸反应的氨气的物质的量是(0.02mol-0.005cvmol)×2=(0.04-0.01cv)mol;
③由于反应需要加热且反应中有碳酸钙生成,因此如果实验所得结果明显偏小,则可能的原因是步骤Ⅰ中未加热反应容器或生成碳酸钙覆盖在固体表面,导致反应不完全.
解答 解:(1)①由于碳化钙极易与水反应,因此U形管中有关盛放固体干燥剂防止水蒸气进入,因此可以是碱石灰或无水氯化钙等;
故答案为:碱石灰或无水氯化钙等;防止空气中的水进入石英管影响实验;
②由于普通玻璃中含有二氧化硅,而在高温下二氧化硅能与碳酸钙反应生成硅酸钙和CO2,所以不能用普通玻璃管代替图中石英管;
故答案为:不能;
(2)由于过量的碳化钙也能与水反应产生气泡,因此要验证含有氮元素,还必须检验生成的气体中含有氨气,所以正确的操作是将湿润的红色石蕊试纸置于容器口,试纸变蓝色,说明固体中含有氮元素;
故答案为:将湿润的红色石蕊试纸置于容器口,试纸变蓝色,说明固体中含有氮元素;
(3)①滴定前溶液显酸性,而b指示剂在酸性条件下是无色的,当硫酸恰好被反应后,硫酸铵溶液还是显酸性的,因此如果用b指示剂,溶液仍然是无色的,因此不宜选用的是b;
故答案为:b;
②样品中有碳化钙,碳化钙能与水反应生成乙炔和氢氧化钙,反应方程式为CaC2+2H2O=C2H2↑+Ca(OH)2,消耗氢氧化钠的物质的量是0.001cvmol,则根据反应式2NaOH+H2SO4=Na2SO4+2H2O可知剩余硫酸的物质的量是0.0005cvmol×$\frac{200mL}{20mL}$=0.005cvmol,所以与氨气反应的硫酸的物质的量是0.02mol-0.005cvmol,则与硫酸反应的氨气的物质的量是(0.02mol-0.005cvmol)×2=(0.04-0.01cv)mol;
故答案为:CaC2+2H2O=C2H2↑+Ca(OH)2;0.04-0.01cv;
③由于反应需要加热且反应中有碳酸钙生成,因此如果实验所得结果明显偏小,则可能的原因是步骤Ⅰ中未加热反应容器或生成碳酸钙覆盖在固体表面,导致反应不完全;
故答案为:步骤Ⅰ中未加热反应容器或生成碳酸钙覆盖在固体表面,导致反应不完全.
点评 本题考查氮的固定,涉及实验方案的设计、滴定原理的应用、质量分数的测定,较为综合,难度较大,弄清实验原理是解题的关键.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | v1=v2 | B. | v1=2v3 | C. | v3=3v2 | D. | v1=v4 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验步骤(不要求写出具体操作过程) | 预期的实验现象和结论 |
| 取少量完全分解的固体产物于试管中,加入稀盐酸 | 若有淡黄色沉淀,则有Na2S2O3存在 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若仅加入催化剂,改变反应途径→降低反应所需要的活化能→活化分子数增多→有效碰撞次数增多→化学反应速率增大 | |
| B. | 若仅增大反应物浓度,单位体积活化分子数增多→单位体积有效碰撞次数增多→化学反应速率增大 | |
| C. | 若仅升高温度,活化分子百分数增加且分子间的碰撞频率提高→有效碰撞次数增多→化学反应速率增大 | |
| D. | 若仅加大体系压强,体积变小→活化分子百分数增加→单位体积的活化分子数目增加→有效碰撞次数增多→化学反应速率增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com