
【题目】原子序数依次增大的四种元素A、B、C、D分别处于第一至第四周期。自然界存在多种A的化合物,B原子核外电子由6种不同的运动状态,B与C可形成正四面体形分子,D的M能层没有空轨道且只有2个未成对电子。请回答下列问题:
(1)A与B元素形成的B2A2种含有的σ键、π键数目之比为________。
(2)B元素的一种单质晶体结构如图1所示,理论上12g该晶体中有________个六元环;图2位在元素周期表中与B相邻的元素位置关系,B、G形成的晶胞结构如图3所示(其中“●”为B元素原子,“〇”为G元素原子),图中“●”点构成的堆积方式与图4中_____(填序号)所表示的堆积方式相同;图3的结构中,设晶胞边长为a cm,B原子直径为bcm,G原子直径为c cm,则该晶胞的空间利用率为_______(用含a、b、c的式子表示)。

(3)请说出E的氟化物(EF3)和F的氢化物(FH3)能发生反应的原因,并写出反应的化学方程式_____(用化学式表示)。
(4)元素C的含氧酸中,酸性最强的是_________(写化学式),该酸根离子的立体构型为________。
(5)基态D原子的核外电子排布式为[Ar]_______;D形成的配合物D(CO)n的中心原子价电子数与配体提供电子总数之和为18,则n=______;由D一铝合金为原料可制得一种历史悠久、应用广泛的催化剂,其催化的i实例为: 化合物b中进行sp3杂化的原子有__________(填元素符号)。
化合物b中进行sp3杂化的原子有__________(填元素符号)。
【答案】 3:2 0.5NA Ⅳ ![]() BF3为中B提供空轨道,NH3中N提供孤电子对,两者以配位键结合方程式NH3+BF3=F3BNH3 HClO4 正四面体 3d84s2 4 C、N、O
BF3为中B提供空轨道,NH3中N提供孤电子对,两者以配位键结合方程式NH3+BF3=F3BNH3 HClO4 正四面体 3d84s2 4 C、N、O
【解析】自然界中存在多种A的化合物,则A为氢元素;B原子核外电子有6种不同的运动状态,即核外有6个电子,则B为碳元素;D的M能层没有空轨道且只有2个未成对电子,则D的核外电子排布式为[Ar]3d84s2 ,即D为28号元素Ni,;结合原子序数可知,C只能处于第三周期,B与C可形成正四面体型分子,则C为氯元素;
(1)H与C元素形成的C2H2的结构式为![]() ,单键均为σ键,碳碳叁键中有一个σ键和二个π键,则含有的σ键、π键数目之比为3:2;
,单键均为σ键,碳碳叁键中有一个σ键和二个π键,则含有的σ键、π键数目之比为3:2;
(2)如图1所示晶体中每个碳原子平衡被3个六元环占用,则一个六元环占用碳原子数为6×![]() =2,12g碳的物质的量为1mol,理论上该晶体中有
=2,12g碳的物质的量为1mol,理论上该晶体中有![]() =0.5NA ;图2为在元素周期表中与B相邻的元素位置关系,则E为B元素,F为N元素,G为Si元素;B、G形成的晶胞结构如图3所示,图中“●”点构成的堆积方式与图4中Ⅳ所表示的堆积方式相同,均为面心立方最密堆积;一个晶胞中含碳原子数为8×
=0.5NA ;图2为在元素周期表中与B相邻的元素位置关系,则E为B元素,F为N元素,G为Si元素;B、G形成的晶胞结构如图3所示,图中“●”点构成的堆积方式与图4中Ⅳ所表示的堆积方式相同,均为面心立方最密堆积;一个晶胞中含碳原子数为8×![]() +6×
+6×![]() =4,Si原子为4,晶胞边长为a,则晶胞的体积为a3,碳和硅原子的总体积为4×
=4,Si原子为4,晶胞边长为a,则晶胞的体积为a3,碳和硅原子的总体积为4×![]() π[
π[![]() +
+![]() ]=
]=![]() π(b3+c3),该晶胞的空间利用率为
π(b3+c3),该晶胞的空间利用率为![]() ;
;
(3)因为BF3为中B提供空轨道,NH3中N提供孤电子对,两者以配位键结合,故BF3和NH3能发生化学反应,此反应的方程式NH3+BF3=F3BNH3;
(4)氯的含氧酸中,酸性最强的是HClO4,高氯酸根离子中心氯原子形成的σ键为4,孤对电子数为![]() =0,则Cl为sp3杂化,立体构型为正四面体;
=0,则Cl为sp3杂化,立体构型为正四面体;
(5)基态Ni原子的核外电子排布式为[Ar]3d84s2 ;中心原子是Ni原子,其价电子数是10,每个配体提供的电子数是2,10+2n=18,n=4;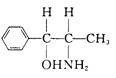 中进行sp3杂化的原子有C、N、O,其中除苯环上的6个C原子外其余3个C原子均为sp3杂化。
中进行sp3杂化的原子有C、N、O,其中除苯环上的6个C原子外其余3个C原子均为sp3杂化。


科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,其中X、Y、Z、W为短周期元素,W元素的核电荷数为X元素的2倍。下列说法正确的是

A. X、W、Z元素的原子半径及它们的气态氢化物的热稳定性均依次递增
B. Y、Z、W元素在自然界中均不能以游离态存在,它们的最高价氧化物的水化物的酸性依次递增
C. YX2晶体熔化、液态WX3气化均需克服分子间作用力
D. 根据元素周期律,可以推测T元素的单质具有半导体特性,T2X3具有氧化性和还原性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B两原子,A原子L层比B原子M层少3个电子,B原子L层电子数恰为A原子L层电子数的2倍,则A、B分别是( )
A. 硅和钠 B. 硼和氮
C. 碳和氯 D. 碳和铝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学中下列各物质间不能实现![]() (“→”表示一步完成)转化的是:
(“→”表示一步完成)转化的是:
A | B | C | D | |
a | CH3CH2OH | CH2===CH2 | 硬脂酸 | HCOOCH3 |
b | CH3CHO | CH3CH2Br | 硬脂酸甘油酯 | CH3OH |
c | CH3COOH | CH3CH2OH | 硬脂酸钠 | HCOOH |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列除去杂质(括号内的物质是杂质)时,选用的试剂或方法正确的是( )
A | B | C | D | |
试样 | NaCl溶液(Na2CO3) | NH4Cl固体(I2) | CO2(SO2) | NaBr溶液(Br2) |
除杂试剂 或方法 | 澄清石灰水 | 加热 | NaOH溶液 | 用CCl4萃取、 分液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)写出下列过程的化学方程式:
①CH3COOCH=CH2![]() A
A![]() B
B
聚合反应:______________________________________________
水解反应:_________________________________________________
②甘氨酸与盐酸反应:____________________________
(2)聚碳酸酯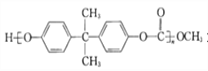 的透光率良好,可制作车、船、飞机的挡风玻璃等。原来合成聚碳酸酯的一种原料是有毒的光气(COCl2),现在改用绿色化学原料碳酸二甲酯
的透光率良好,可制作车、船、飞机的挡风玻璃等。原来合成聚碳酸酯的一种原料是有毒的光气(COCl2),现在改用绿色化学原料碳酸二甲酯![]() 与___________(填字母序号)缩合聚合而成。
与___________(填字母序号)缩合聚合而成。
a.二卤代物 b.二酚类 c.二醛类 d.二烯类
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】S2Cl2是工业上常用的硫化剂,已知S2C12中硫元素显+1价,它不稳定,在水中易发生岐化反应,易溶于有机溶剂。实验室常用CS2与纯净的氯气制备S2C12。反应涉及到的几种物质的熔沸点如下:
物质 | CS2 | Cl2 | CCl4 | S2C12 |
沸点/℃ | 47 | -34.6℃ | 77 | 137 |
熔点/℃ | -109 | -100.98℃ | -23 | -77 |
实验室利用下列装置制备S2C12 (部分夹持仪器己略去):
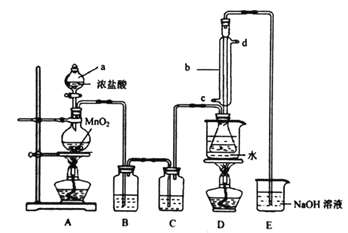
回答下列问题:
(1)装置中b玻璃仪器的名称为_______;写出制备S2C12的化学方程式_______。
(2)整套装置装配完毕后,首先进行的操作是________,再添加试剂。
(3)实验中盐酸试剂通常采用36.5%的浓盐酸,不用稀盐酸的理由是________。
装置A中反应的离子方程式是___________。
(4) D中采用热水浴加热的原因是__________,反应结束后从锥形瓶内混合物中分离出产品的方法是_______________。
(5)实验过程中,若缺少C装置,则发现产品浑浊不清,出现该现象的原因化学方程式表示为__________。
(6)该实始装置设计存在缺陷,你的改进建议及改进目的是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某矿样含有大量的CuS及少量其它不溶于酸的杂质。实验室中以该矿样为原料制备CuCl2·2H2O晶体,流程如下:

(1)在实验室中,欲用37%(密度为1.19 g·mL-1)的盐酸配制500 mL 6mol·L-1的盐酸,需要的仪器除量筒、烧杯、玻璃棒外,还有__________________、__________________。
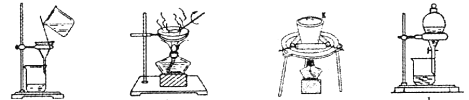
(2)①若在实验室中完成系列操作a。则下列实验操作中,不需要的是___________(填下列各项中序号)。
②CuCl2溶液中存在如下平衡: ![]() 欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中,还需要的是 _________(填下列各项中序号)。
欲用实验证明滤液A(绿色)中存在上述平衡,除滤液A外,下列试剂中,还需要的是 _________(填下列各项中序号)。
a.FeCl3固体 b.CuCl2固体 c.蒸馏水
(3)某化学小组欲在实验室中研究CuS焙烧的反应过程,查阅资料得知在空气条件下焙烧 CuS时,固体质量变化曲线及SO2生成曲线如下图所示。
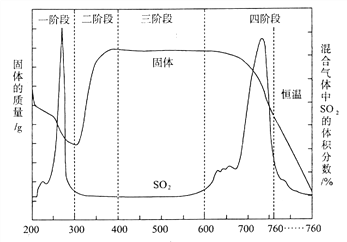
① CuS矿样在焙烧过程中,有![]() 生成,转化顺序为:
生成,转化顺序为:
![]()
第①步转化主要在200~300℃范围内进行,该步转化的化学方程式为________________________。
② 300~400℃范围内,固体质量明显增加的原因是__________________________,上图所示过程中,CuSO4固体能稳定存在的阶段是_________________(填下列各项中序号)。
a.一阶段 b.二阶段 c.三阶段 d.四阶段
③ 该化学小组设计如下装置模拟CuS矿样在氧气中焙烧第四阶段的过程,并验证所得气体为SO2和O2的混合物。
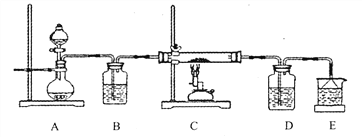
a.装置组装完成后,应立即进行的一项操作是___________________________。
b.当D装置中产生白色沉淀时,便能说明第四阶段所得气体为SO2和O2的混合物,你认为装置D中原来盛有的溶液为______________溶液。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com