
【题目】按要求回答下列问题:
(1)写出乙烯分子的电子式:___________。
(2)写出(2-甲基-1,3-丁二烯)的结构简式_________。
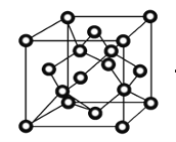
(3)立方烷![]() 的一氯代物有_________种,它的六氯代物有_________种。
的一氯代物有_________种,它的六氯代物有_________种。
(4)下列物质的沸点按由高到低的顺序排列正确的是___________。
①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③(CH3)3CH ④(CH3)2CHCH2CH3
A.②④①③ B.④②①③ C.④③②① D.②④③①
(5)下列选项中互为同系物的是_________;互为同分异构体的是______________;属于同种物质的是_____________。
①H2O和D2O ②1H、2H、3H ③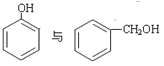 ④.
④.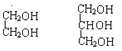 ⑤
⑤![]() ⑥戊烯和环戊烷 ⑦
⑥戊烯和环戊烷 ⑦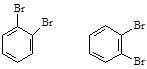
【答案】![]()
![]() 1 3 A ⑤ ⑥ ①⑦
1 3 A ⑤ ⑥ ①⑦
【解析】
(1)乙烯分子中两个C原子形成2对共用电子对,每个C原子与2个H原子分别形成1对共用电子对;
(2)2-甲基-1,3-丁二烯在主链上有四个C原子,在1、2号C原子核3、4号C原子之间存在2个碳碳双键;在2号C原子上有一个甲基,据此书写;
(3)立方烷结构对称,含有1种H,二氯代物有一条棱、面对角线、体对角线上3种位置,六氯代物与二氯代物的同分异构体数目相同;
(4)根据烷烃的物理性质随着分子中碳原子数的递增呈规律性变化,沸点逐渐升高;碳原子数相同的烃,支链越多,熔、沸点越低来分析;
(5)具有相同分子式而结构不同的化合物互为同分异构体;
同系物指结构相似、通式相同,组成上相差1个或者若干个CH2原子团,具有相同官能团的化合物;
组成和结构都相同的物质为同一物质,同一物质组成、结构、性质都相同,结构式的形状及物质的聚集状态可能不同。
(1)乙烯分子C2H4中两个C原子形成2对共用电子对,每个C原子与2个H原子分别形成1对共用电子对,每个原子都达到稳定结构,电子式为![]() ;
;
(2)根据烯烃的烯烃命名方法,可知2-甲基-1,3-丁二烯的结构简式为![]() ;
;
(3)有一种等效H原子,二氯代物有一条棱、面对角线、体对角线上3种位置,一氯代物有一种,二氯代物有三种,分子中共含有8个H原子,则六氯代物与二氯代物的同分异构体数目相同,所以六氯代物的同分异构体数目为3种;
(4)烷烃的物理性质随着分子中碳原子数的递增呈规律性变化,沸点逐渐升高;碳原子数相同的烃,支链越多,熔沸点越低。①、③中碳原子都是4个,②无支链,沸点:①>③;②、④中碳原子数为5,比①、③中碳原子数都多,则沸点较高,故沸点按由高到低的顺序排列是②④①③,故合理选项是A;
(5)⑤结构相似,分子式不同,互为同系物;
⑥结构不同,分子式相同,互为同分异构体;
①⑦分子式相同,结构相同,为相同物质,
故互为同系物的是⑤;互为同分异构体的是⑥;属于同种物质的是①⑦。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】硫、锌及其化合物用途非常广泛。回答下列问题:
(1)O和S处于同一主族。H2O及H2S中,中心原子的杂化方式相同,键长及键角如图所示。
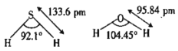
①H2O分子中的键长比H2S中的键长短,其原因是________。
②H2O分子中的键角∠HOH比H2S分子中的键角∠HSH大,其原因是________。
(2)单质硫与热的NaOH浓溶液反应的产物之一为Na2S3。S32-的空间构型为______,中心原子的杂化方式为_______。
(3)噻吩(![]() )广泛应用于合成医药、农药、染料工业。
)广泛应用于合成医药、农药、染料工业。
①噻吩分子中含有______个σ键。
②分子中的大π键可用符号![]() 表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为
表示,其中m代表参与形成大π键的原子数,n代表参与形成大π键的电子数(如苯分子中的大π键可表示为![]() ),则噻吩分子中的大π键应表示为________。
),则噻吩分子中的大π键应表示为________。
③噻吩的沸点为84℃,吡咯(![]() )的沸点在129~131℃之间,后者沸点较高,其原因是_________。
)的沸点在129~131℃之间,后者沸点较高,其原因是_________。
(4)冰晶体的结构与金刚石的结构相似,属立方晶系。如图,将金刚石晶胞中的C原子全部置换成O原子,O原子与最近距离的四个O原子相连,H原子插入两个相连的O原子之间,与氧形成一个共价键和一个氢键,即为冰中的共价键和氢键。0℃时冰晶体中氢键的键长(定义氢键的键长为O—H…O的长度)为_____cm(列出计算式即可)。(0℃时冰密度为0.9g/cm3。)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物的反应往往伴随副反应发生,因此需要分离提纯。有一种水果香精的合成步骤如下:
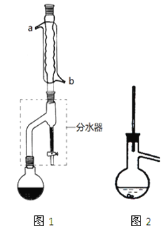
Ⅰ合成:
在干燥的圆底烧瓶中加11.5mL(9.3g,0.125mol)正丁醇、7.2mL(7.5g,0.125mol)冰醋酸(乙酸)和3~4滴浓H2SO4,摇匀后,加几粒沸石,再按图1所示装置安装好。在分水器中预先加入5.00mL水,其水面低于分水器回流支管下沿3~5mm,然后用小火加热,反应大约40min。
Ⅱ分离提纯:
①当分水器中的液面不再升高时,冷却,放出分水器中的水,把反应后的溶液与分水器中的酯层合并,转入分液漏斗中,用10mL10%碳酸钠溶液洗至酯层无酸性(pH=7),充分振荡后静置,分去水层。
②将酯层倒入小锥形瓶中,加少量无水硫酸镁干燥(生成MgSO47H2O晶体)
③将乙酸正丁酯粗产品转入50mL蒸馏烧瓶中,加几粒沸石进行常压蒸馏,收集产品,主要试剂及产物的物理常数如下:
化合物 | 正丁醇 | 冰醋酸 | 乙酸正丁酯 | 正丁醚 |
密度/(g/mL) | 0.810 | 1.049 | 0.882 | 0.7689 |
沸点/℃ | 117.8 | 118.1 | 126.1 | 143 |
在水中的溶解性 | 易溶 | 易溶 | 难溶 | 难溶 |
制备过程中还可能与的副反应有2CH3CH2CH2CH2OH![]() CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
CH3CH2CH2CH2OCH2CH2CH2CH3+H2O
根据以上信息回答下列问题:
(1)写出合成乙酸正丁酯的化学方程式____________。
(2)如图1整个装置可看作由分水器、圆底烧瓶和冷凝管组成,其中冷水应从______(填a或b)管口通入。
(3)步骤①中碳酸钠溶液的作用主要是除去硫酸、_________、___________。
(4)在操作步骤②后(即酯层用无水硫酸镁干燥后),应先___________(填实验操作名称),然后将乙酸正丁酯粗产品转入蒸馏烧瓶中,如果蒸馏装置如图2所示,则收集到的产品中可能混有___________________杂质。
(5)步骤③的常压蒸馏,需控制一定的温度,你认为在_______中加热比较合适(请从下列选项中选择)。
A.水 B.甘油(沸点290℃) C.石蜡油(沸点200~300℃) D.沙子
(6)反应结束后,若放出的水为6.98mL(水的密度为1g/mL),则正丁醇的转化率约为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 按系统命名法,![]() 的名称为2,4,5-三甲基己烷
的名称为2,4,5-三甲基己烷
B. 3-甲基-3-乙基戊烷的一氯取代产物有6种
C. 化合物![]() 是苯的同系物
是苯的同系物
D. 分子![]() 中,位于同一平面上碳原子最多有6个
中,位于同一平面上碳原子最多有6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.1molO2与金属Na反应,O2一定得到4NA个电子
B.18gNH4+中所含的电子数为11NA
C.1molFe与足量的Cl2反应,转移的电子数为2NA
D.1molCl2与足量的Fe反应,转移的电子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是一种常见的有机物,下列有关该物质的说法不正确的是( )
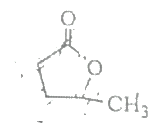
A. 分子式为C5H8O2,分子中有15个σ键和1个π键
B. 分子中的碳氧键有2种键长
C. 该物质在光照条件下与氯气反应,形成新的σ键
D. 该物质在碱性条件下加热,断裂的是非极性键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铜是人类发现最早并广泛使用的一种金属。回答下列问题:
(1)实验室使用稀硫酸和H2O2溶解铜片,该反应的化学方程式为___。
(2)电子工业使用FeCl3溶液刻蚀印刷电路板铜箔,写出该过程的离子方程式___,配制的FeCl3溶液应保持酸性,原因是__。
(3)溶液中Cu2+的浓度可采用碘量法测得:
①2Cu2++5I-=2CuI↓+I3-
②I3-+2S2O32-=S4O62-+3I-
现取20.00mL含Cu2+的溶液,加入足量的KI充分反应后,用0.1000mol·L-1的Na2S2O3标准溶液滴定至终点,消耗Na2S2O3溶液25.00mL,此溶液中Cu2+的浓度为__mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关同分异构体的叙述正确的是
A. 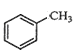 苯环上的一个氢原子被含1个氯原子取代,所得产物有5种
苯环上的一个氢原子被含1个氯原子取代,所得产物有5种
B. 丁烷(C4H10)的二氯取代物只能有4种
C. 菲的结构式为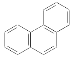 ,其一硝基取代物有10种
,其一硝基取代物有10种
D. 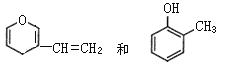 互为同分异构体
互为同分异构体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com