
下列关于元素的叙述正确的是
A.金属元素与非金属元素能形成共价化合物
B.只有在原子中,质子数才与核外电子数相等
C.目前使用的元素周期表中,最长的周期含有36种元素
D.非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为________。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_______ _____(写化学式),非金属气态氢化物还原性最强的是________ ____(写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有____________(写出其中两种物质的化学式)。
(4)X2M的燃烧热ΔH=-a kJ·mol-1,写出X2M燃烧反应的热化学方程式:____________。
(5)ZX的电子式为____________;ZX与水反应放出气体的化学方程式为____________。
(6)熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为:2Z+FeG2 Fe+2ZG
Fe+2ZG
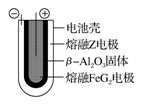
放电时,电池的正极反应式为____________;充电时,______ ______(写物质名称)电极接电源的负极:该电池的电解质为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下表信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.氢化物的沸点为H2T<H2R B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
下列两题分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,请你选择其中一题作答,如果两题全做,则按A题评分。
A.已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物的分子空间构型是 。其中心原子采取 杂化。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4)E的核外电子排布式是 ,ECl3形成的配合物的化学式为 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 。
B.醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下:
NaBr+H2SO4 HBr+NaHSO4 ①
HBr+NaHSO4 ①
R-OH+HBr R-Br+H2O ②
R-Br+H2O ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br—被浓硫酸氧化为Br2等。有关数据列表如下;
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/g·cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
请回答下列问题:
(1)在溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是 。(填字母)
a.圆底烧瓶 b.量筒 c.锥形瓶 d.布氏漏斗
(2)溴代烃的水溶性 (填“大于”、“等于”或“小于”)相应的醇;其原因是
。
(3)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在 (填“上层”、“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必须进行稀释,起目的是 。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(5)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是 。(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(6)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于 ;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于元素周期表和元素周期律的说法错误的是
A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多
B.第二周期元素从Li到F,非金属性逐渐增强
C.因为Na比K容易失去电子,所以Na比K的还原性强
D.O与S为同主族元素,且O比S的非金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
设想你去某外星球做了一次科学考察,采集了该星球上十种元素单质的样品,为了确定这些元素的相对位置以便系统地进行研究,你设计了一些实验并得到下列结果:
| 单质 | A | B | C | D | E | F | G | H | I | J |
| 熔点(℃) | -150 | 550 |
| 210 | -50 | 370 | 450 | 300 | 260 | 250 |
| 与水反应 | √ | √ | √ | √ | ||||||
| 与酸反应 | √ | √ | √ | √ | √ | √ | ||||
| 与氧气 反应 | √ | √ | √ | √ | √ | √ | √ | √ | ||
| 不发生 化学反应 | √ | √ | ||||||||
| 相对于A元素的原子质量 | 1.0 | 8.0 | 15.6 | 17.1 | 23.8 | 31.8 | 20.0 | 29.6 | 3.9 | 18.0 |
按照元素性质的周期递变规律,试确定以上十种元素的相对位置,并填入下表:
| A | ||||||||
| B | ||||||||
| H | ||||||||
查看答案和解析>>
科目:高中化学 来源: 题型:
下图中每条折线表示周期表ⅥA~ⅦA中的某一族元素氢化物的沸点变化,每个小黑点代表一种氢化物,其中a点代表的是
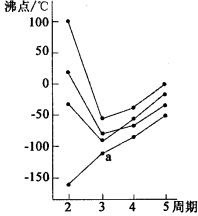
A.H2S B.HCl C.PH3 D.SiH4
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于电离能和电负性的说法不正确的是
A.(2012·浙江)第一电离能的大小:Mg>Al
B.(2012·海南)锗的第一电离能高于碳而电负性低于碳
C.(2012·山东)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是碳
D.(2013·新课标Ⅱ)F、K、Fe、Ni四种元素中电负性最大的是F
查看答案和解析>>
科目:高中化学 来源: 题型:
海洋中蕴藏着丰富资源,对它的开发利用有利于缓解当前资源紧张的困局,工业上从海水中提取的某些无机物的简易流程可以用下图表示:
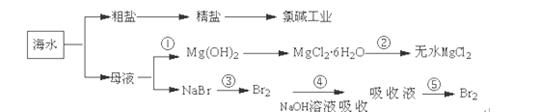
下列有关说法不正确的是
A.氯碱工业中采用阳离子交换膜电解槽,可以防止氯气与碱的反应
B.第②步中结晶出的MgCl2·6H2O不能采用直接在空气中受热分解制无水MgCl2
C.第①步常采用往母液中加浓NaOH溶液来获取Mg(OH)2
D.从第③步到第⑤步的目的是获得含溴单质浓度较高的溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com