
根据下表信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.氢化物的沸点为H2T<H2R B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等
 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源: 题型:
糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质,以下叙述正确的是
A.糖类是热值最高的营养物质
B.蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水
C.油脂是油和脂肪的统称,油脂属于酯类
D.在蛋白质溶液中加入饱和硫酸铵溶液,析出的蛋白质再加水也不溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
以下有关原子结构及元素周期律的叙述正确的是
A.第IA族元素铯的两种同位素137Cs比133Cs多4个质子
B.同周期元素(除0族元素外)从左到右,原子半径逐渐减小
C.第 ⅦA元素从上到下,其氢化物的稳定性逐渐增强
D.同主族元素从上到下,单质的熔点逐渐降低
查看答案和解析>>
科目:高中化学 来源: 题型:
各物质之间的转化关系如下图,部分生成物省略。C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷电路板。
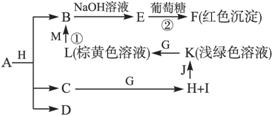
请回答下列问题:
(1)写出A的化学式_____________,C的电子式____________。
(2)比较Y与Z 的原子半径大小____________>____________(填写元素符号)。
的原子半径大小____________>____________(填写元素符号)。
(3)写出反应②的化学方程式(有机物用结构简式表示)____________,举出该反应的一个应用实例________________________。
(4)已知F溶于稀硝酸,溶液变成蓝色,并放出无色气体。请写出该反应的化学方程式:____________________________________。
(5)研究表明:气体D在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为正四面
体,请写出N及其2种同素异形体的名称____________、____________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:

(1)④、⑤、⑥的原子半径由大到小的顺序是__________________。
(2)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是______________。
(3)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______________。
(4)由表中两种元素的原子按1∶1组成的常见液态化合物的稀溶液易被催化分解,可使用的催化剂为(填序号)______________。
a.MnO2 b.FeCl3 c.Na2SO3 d.KMnO4
(5)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
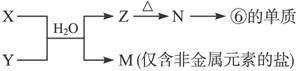
X溶液与Y溶液反应的离子方程式为______________,N→⑥的单质的化学方程式为______________,常温下,为使0.1 mol/L M溶液中由M电离的阴、阳离子浓度相等,应向溶液中加入一定量的Y溶液至______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为______________________________________________。
(2)W与Y可形成化合物W2Y,该化合物的电子式为___________________________。
(3)X的硝酸盐水溶液显____________性,用离子方程式解释原因:____________________。
(4)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为_________________。
(5)比较Y、Z气态氢化物的稳定性:______________>____________。(用分子式表示)
(6)W、X、Y、Z四种元素简单离子的离子半径由大到小的顺序是_________>___________>____________>__________。
(7)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量。写出该反应的热化学方程式:_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.SiH4比CH4稳定
B.O2-半径比F-的小
C.Na和Cs属于第ⅠA族元素,Cs失电子能力比Na的强
D.P和As属于第ⅤA族元素,H3PO4酸性比H3AsO4的弱
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于元素的叙述正确的是
A.金属元素与非金属元素能形成共价化合物
B.只有在原子中,质子数才与核外电子数相等
C.目前使用的元素周期表中,最长的周期含有36种元素
D.非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8
查看答案和解析>>
科目:高中化学 来源: 题型:
某种元素的电离能数据如下(单位:kJ·mol-1),该元素最可能是
| I1 | I2 | I3 | I4 |
| 740 | 1 500 | 7 700 | 10 500 |
A.s区元素 B.f区元素
C.p区元素 D.d区元素
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com