
各物质之间的转化关系如下图,部分生成物省略。C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷电路板。
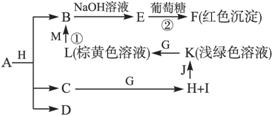
请回答下列问题:
(1)写出A的化学式_____________,C的电子式____________。
(2)比较Y与Z 的原子半径大小____________>____________(填写元素符号)。
的原子半径大小____________>____________(填写元素符号)。
(3)写出反应②的化学方程式(有机物用结构简式表示)____________,举出该反应的一个应用实例________________________。
(4)已知F溶于稀硝酸,溶液变成蓝色,并放出无色气体。请写出该反应的化学方程式:____________________________________。
(5)研究表明:气体D在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为正四面
体,请写出N及其2种同素异形体的名称____________、____________、____________。
【答案】
(1)Cu2(OH)2CO3或CuCO3 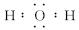
(2)C>O
(3)CH2OH(CHOH)4—CHO+2Cu(OH)2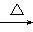 CH2OH—(CHOH)4—COOH+Cu2O↓+2H2O 医学上用于检验糖尿病
CH2OH—(CHOH)4—COOH+Cu2O↓+2H2O 医学上用于检验糖尿病
(4)3Cu2O+14HNO3(稀)====6Cu(NO3)2+2NO↑+7H2O
(5)金刚石 石墨 富勒烯(C60)
【解析】题干信息分析:“在周期表中X的原子半径最小”确定X是H元素。“G为黄绿色单质气体”确定G是Cl2。“反应①常用于制作印刷电路板”这个学生都熟悉,是Fe3+与Cu的反应。通过对框图信息分析:结合题干,K(浅绿色溶液)→L(棕黄色溶液)应是Fe2+→Fe3+。F是Cu2O沉淀。M是金属Cu,J是金属Fe。C是H2O,它与G(Cl2)反应生成的H是HCl,I是次氯酸(与题干中的“漂白作用”吻合)。B 则是以CuCl2为主,生成的E是Cu(OH)2。A物质能与盐酸反应生成CuCl2和H2O,考虑D是无色非可燃性气体,应以CO2可能性较大。故符合题意的A可以是CuCO3,也可能是碱式碳酸铜。(1)A的化学式应写成“Cu2(OH)2CO3或CuCO3”。C的电子式是写H2O的电子式。(2)X是H元素
则是以CuCl2为主,生成的E是Cu(OH)2。A物质能与盐酸反应生成CuCl2和H2O,考虑D是无色非可燃性气体,应以CO2可能性较大。故符合题意的A可以是CuCO3,也可能是碱式碳酸铜。(1)A的化学式应写成“Cu2(OH)2CO3或CuCO3”。C的电子式是写H2O的电子式。(2)X是H元素 ,Y是C元素,Z是O元素,故此项应是“C>O”。(3)方程式是写新制Cu(OH)2与葡萄糖反应的,注意加热符号及沉淀符号。其应用就是在医学上检验糖尿病,即检验尿液中的葡萄糖。(4)考查方程式的书写,物质清楚,主要是配平问题可根据得失电子守恒配平。(5)气体D是CO2,注意问题中“被还原”这个关键词,确定N应是金刚石,其同素异形体主要有石墨、C60、碳纳米管等。
,Y是C元素,Z是O元素,故此项应是“C>O”。(3)方程式是写新制Cu(OH)2与葡萄糖反应的,注意加热符号及沉淀符号。其应用就是在医学上检验糖尿病,即检验尿液中的葡萄糖。(4)考查方程式的书写,物质清楚,主要是配平问题可根据得失电子守恒配平。(5)气体D是CO2,注意问题中“被还原”这个关键词,确定N应是金刚石,其同素异形体主要有石墨、C60、碳纳米管等。


 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
右图为Cu-Zn原电池示意图,下列叙述正确的是
A.锌为负极,发生还原反应
B.铜为负极,铜片上有气泡产生
C.电子由铜片通过导线流向锌片
D.溶液中的H+从铜片获得电子被还原成氢原子
 |
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为________。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_______ _____(写化学式),非金属气态氢化物还原性最强的是________ ____(写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有____________(写出其中两种物质的化学式)。
(4)X2M的燃烧热ΔH=-a kJ·mol-1,写出X2M燃烧反应的热化学方程式:____________。
(5)ZX的电子式为____________;ZX与水反应放出气体的化学方程式为____________。
(6)熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为:2Z+FeG2 Fe+2ZG
Fe+2ZG
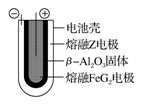
放电时,电池的正极反应式为____________;充电时,______ ______(写物质名称)电极接电源的负极:该电池的电解质为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列说法正确的是
A.形成离子键的阴阳离子间只存在静电吸引力
B.HF、HC L、HBr、HI的热稳定性和还原性从左到右依次减弱
L、HBr、HI的热稳定性和还原性从左到右依次减弱
C.第三周期非金属元素含氧酸的酸性从左到右依次增强
D.元素周期律是元素原子核外电子排布周期性变化的结果
查看答案和解析>>
科目:高中化学 来源: 题型:
金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和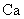 ,并含有3.5%(质量分数)
,并含有3.5%(质量分数)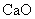 .
.
(1)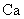 元素在周期表中位置是 ,其原子结构示意图 .
元素在周期表中位置是 ,其原子结构示意图 .
(2)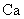 与最活跃的非金属元素A形成化合物D,D的电子式为 ,D的沸点比A与
与最活跃的非金属元素A形成化合物D,D的电子式为 ,D的沸点比A与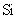 形成的化合物E的沸点 .
形成的化合物E的沸点 .
(3)配平用钙线氧脱鳞的化学方程式:
P+ FeO+ CaO
 + Fe
+ Fe
(4)将钙线试样溶于稀盐酸后,加入过量 溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色
溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色 .则金属M为______;检测
.则金属M为______;检测 的方法是_____(用离子方程式表达).
的方法是_____(用离子方程式表达).
(5)取1.6g钙线试样,与水充分反映,生成224ml. (标准状况),在想溶液中通入适量的
(标准状况),在想溶液中通入适量的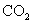 ,最多能得到
,最多能得到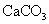 g.
g.
查看答案和解析>>
科目:高中化学 来源: 题型:
某元素只存在两种天然同位素,且在自然界它们的含量相近,其相对原子质量为152.0,原子核外的电子数为63。下列叙述中错误的是( )
A.它是副族元素
B.它是第六周期元素
C.它的原子核内有63个质子
D.它的一种同位素的核内有89个中子
查看答案和解析>>
科目:高中化学 来源: 题型:
根据下表信息,判断以下叙述正确的是( )
部分短周期元素的原子半径及主要化合价
| 元素代号 | L | M | Q | R | T |
| 原子半径/nm | 0.160 | 0.143 | 0.112 | 0.104 | 0.066 |
| 主要化合价 | +2 | +3 | +2 | +6、-2 | -2 |
A.氢化物的沸点为H2T<H2R B.单质与稀盐酸反应的速率为L<Q
C.M与T形成的化合物具有两性 D.L2+与R2-的核外电子数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
下列两题分别对应于“物质结构与性质”和“实验化学”两个选修课程模块的内容,请你选择其中一题作答,如果两题全做,则按A题评分。
A.已知A、B、C、D、E都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配位的配合物,且两种配体的物质的量之比为2∶1,三个氯离子位于外界。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为 。
(2)B的氢化物的分子空间构型是 。其中心原子采取 杂化。
(3)写出化合物AC2的电子式 ;一种由B、C组成的化合物与AC2互为等电子体,其化学式为 。
(4)E的核外电子排布式是 ,ECl3形成的配合物的化学式为 。
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是 。
B.醇与氢卤酸反应是制备卤代烃的重要方法。实验室制备溴乙烷和1-溴丁烷的反应如下:
NaBr+H2SO4 HBr+NaHSO4 ①
HBr+NaHSO4 ①
R-OH+HBr R-Br+H2O ②
R-Br+H2O ②
可能存在的副反应有:醇在浓硫酸的存在下脱水生成烯和醚,Br—被浓硫酸氧化为Br2等。有关数据列表如下;
| 乙醇 | 溴乙烷 | 正丁醇 | 1-溴丁烷 | |
| 密度/g·cm-3 | 0.7893 | 1.4604 | 0.8098 | 1.2758 |
| 沸点/℃ | 78.5 | 38.4 | 117.2 | 101.6 |
请回答下列问题:
(1)在溴乙烷和1-溴丁烷的制备实验中,下列仪器最不可能用到的是 。(填字母)
a.圆底烧瓶 b.量筒 c.锥形瓶 d.布氏漏斗
(2)溴代烃的水溶性 (填“大于”、“等于”或“小于”)相应的醇;其原因是
。
(3)将1-溴丁烷粗产品置于分液漏斗中加水,振荡后静置,产物在 (填“上层”、“下层”或“不分层”)。
(4)制备操作中,加入的浓硫酸必须进行稀释,起目的是 。(填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成
c.减少HBr的挥发 d.水是反应的催化剂
(5)欲除去溴代烷中的少量杂质Br2,下列物质中最适合的是 。(填字母)
a.NaI b.NaOH c.NaHSO3 d.KCl
(6)在制备溴乙烷时,采用边反应边蒸出产物的方法,其有利于 ;但在制备1-溴丁烷时却不能边反应边蒸出产物,其原因是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于电离能和电负性的说法不正确的是
A.(2012·浙江)第一电离能的大小:Mg>Al
B.(2012·海南)锗的第一电离能高于碳而电负性低于碳
C.(2012·山东)Ni是元素周期表中第28号元素,第二周期基态原子未成对电子数与Ni相同且电负性最小的元素是碳
D.(2013·新课标Ⅱ)F、K、Fe、Ni四种元素中电负性最大的是F
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com