
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为________。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_______ _____(写化学式),非金属气态氢化物还原性最强的是________ ____(写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有____________(写出其中两种物质的化学式)。
(4)X2M的燃烧热ΔH=-a kJ·mol-1,写出X2M燃烧反应的热化学方程式:____________。
(5)ZX的电子式为____________;ZX与水反应放出气体的化学方程式为____________。
(6)熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为:2Z+FeG2 Fe+2ZG
Fe+2ZG
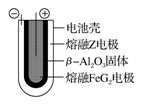
放电时,电池的正极反应式为____________;充电时,______ ______(写物质名称)电极接电源的负极:该电池的电解质为________。
答案:(1)第二周期第ⅥA族
(2)HClO4 H2S
(3)Cl2 ClO2 O3(写两种)
(4)H2S(g)+ O2(g)===H2O(l)+SO2(g)
O2(g)===H2O(l)+SO2(g)
ΔH=-a kJ·mol-1
(5)Na+[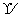 H]- NaH+H2O===NaOH+H2↑
H]- NaH+H2O===NaOH+H2↑
(6)Fe2++2e-===Fe 钠 β-Al2O3
解析:五种短周期元素,原子序数依次增大,X、Z同主族,可形成离子化合物ZX,可判断X为氢,Z为钠;Y、M同主族,可形成MY2、MY3两种分子,可判断Y为氧,M为硫,则G为氯。
(1)Y(氧)在周期表中第二周期第ⅥA族。
(2)上述元素中非金属性最强的为Cl,所以其最高价氧化物对应的水化物HClO4酸性最强,非金属气态氢化物中还原性最强的是H2S。
(3)氧、氯的单质或两者的化合物中可用作自来水消毒的是Cl2、O3、ClO2等。
(4)H2S(g)+ O2(g)===H2O(l)+SO2(g) ΔH=-a kJ·mol-1。
O2(g)===H2O(l)+SO2(g) ΔH=-a kJ·mol-1。
(5)NaH的电子式Na+[ H]-,与水反应的化学方程式为NaH+H2O===NaOH+H2↑。
H]-,与水反应的化学方程式为NaH+H2O===NaOH+H2↑。
(6)对充电电池反应2Na+FeCl2 Fe+2NaCl,放电时,正极发生还原反应:Fe2++2e-===Fe,充电时,接电源负极的阴极发生还原反应:2Na++2e-===2Na,所以钠电极接电源负极,在该电池中β-Al2O3为导电介质。
Fe+2NaCl,放电时,正极发生还原反应:Fe2++2e-===Fe,充电时,接电源负极的阴极发生还原反应:2Na++2e-===2Na,所以钠电极接电源负极,在该电池中β-Al2O3为导电介质。


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:
短周期元素X、Y、Z在元素周期表中的位置如右下图所示,下列说法正确的是
 A.X、Y、Z三种元素中,X的非金属性最强
A.X、Y、Z三种元素中,X的非金属性最强
B.X的单质的熔点比Z的低
C.Y的最高正化合价为+7
D.Y的氢化物的稳定性比Z的弱
查看答案和解析>>
科目:高中化学 来源: 题型:
糖类、脂肪和蛋白质是维持人体生命活动所必需的三大营养物质,以下叙述正确的是
A.糖类是热值最高的营养物质
B.蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水
C.油脂是油和脂肪的统称,油脂属于酯类
D.在蛋白质溶液中加入饱和硫酸铵溶液,析出的蛋白质再加水也不溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
下列物质露置在空气中易变质的是( )
①漂白粉 ②苯酚 ③水玻璃 ④硫酸钠 ⑤烧碱 ⑥亚硫酸钠 ⑦胆矾 ⑧硬化油 ⑨Vc
A.除④⑦⑧外 B.除④⑦外
C.除⑥⑦⑧外 D.全部易变质
查看答案和解析>>
科目:高中化学 来源: 题型:
已知33As、35Br位于同一周期。下列关系正确的是( )
A.原子半径:As>Cl>P
B.热稳定性:HCl>AsH3>HBr
C.还原性:As3->S2->Cl-
D.酸性:H3AsO4> H2SO4>H3PO4
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素甲、乙、丙、丁的原子序数依次增大,甲和乙形成的气态化合物的水溶液呈碱性,乙位于第VA族,甲和丙同主族,丁原子最外层电子数与电子层数相等,则
A、原子半径:丙>丁>乙
B、单质的还原性:丁>丙>甲
C、甲、乙、丙的氧化物均为共价化合物
D、乙、丙、丁的最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
以下有关原子结构及元素周期律的叙述正确的是
A.第IA族元素铯的两种同位素137Cs比133Cs多4个质子
B.同周期元素(除0族元素外)从左到右,原子半径逐渐减小
C.第 ⅦA元素从上到下,其氢化物的稳定性逐渐增强
D.同主族元素从上到下,单质的熔点逐渐降低
查看答案和解析>>
科目:高中化学 来源: 题型:
各物质之间的转化关系如下图,部分生成物省略。C、D是由X、Y、Z中两种元素组成的化合物,X、Y、Z的原子序数依次增大,在周期表中X的原子半径最小,Y、Z原子最外层电子数之和为10。D为无色非可燃性气体,G为黄绿色单质气体,J、M为金属,I有漂白作用,反应①常用于制作印刷电路板。
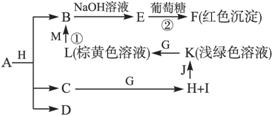
请回答下列问题:
(1)写出A的化学式_____________,C的电子式____________。
(2)比较Y与Z 的原子半径大小____________>____________(填写元素符号)。
的原子半径大小____________>____________(填写元素符号)。
(3)写出反应②的化学方程式(有机物用结构简式表示)____________,举出该反应的一个应用实例________________________。
(4)已知F溶于稀硝酸,溶液变成蓝色,并放出无色气体。请写出该反应的化学方程式:____________________________________。
(5)研究表明:气体D在一定条件下可被还原为晶莹透明的晶体N,其结构中原子的排列为正四面
体,请写出N及其2种同素异形体的名称____________、____________、____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于元素的叙述正确的是
A.金属元素与非金属元素能形成共价化合物
B.只有在原子中,质子数才与核外电子数相等
C.目前使用的元素周期表中,最长的周期含有36种元素
D.非金属元素形成的共价化合物中,原子的最外层电子数只能是2或8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com