
已知33As、35Br位于同一周期。下列关系正确的是( )
A.原子半径:As>Cl>P
B.热稳定性:HCl>AsH3>HBr
C.还原性:As3->S2->Cl-
D.酸性:H3AsO4> H2SO4>H3PO4
科目:高中化学 来源: 题型:
已知某种气态矿物燃料含有碳、氢两种元素。为了测定这种燃料中碳、氢
两种元素的质量比,可将气态燃料放入足量的氧气中燃烧,并使产生的气体全
部通入下图所示的装置,得到如下表所列的实验结果(假设产生的气体完全被吸
 收)。
收)。
| 实验前 | 实验后 | |
| (干燥剂+U形管)的质量 | 101. 1 g | 102. 9 g |
| (石灰水+广口瓶)的质量 | 312. 0 g | 314. 2 g |
根据实验数据,求:
① 实验完毕后,生成物中水的物质的量为 mol,假设广口瓶里生成一种正盐,其质量为 g;
② 气态矿物燃料中碳元素与氢元素的质量比为 ;
③ 该气态矿物燃料的分子式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
一定条件下新制的氯水中,加入少量下列物质,能使HClO的浓度增大的是( )
①CaCO3(固) ②AgNO3(1 mol·L-1) ③蒸馏水
A.①② B.②
C.②③ D.①
查看答案和解析>>
科目:高中化学 来源: 题型:
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子。
请回答下列问题:
(1)Y在元素周期表中的位置为________。
(2)上述元素的最高价氧化物对应的水化物酸性最强的是_______ _____(写化学式),非金属气态氢化物还原性最强的是________ ____(写化学式)。
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有____________(写出其中两种物质的化学式)。
(4)X2M的燃烧热ΔH=-a kJ·mol-1,写出X2M燃烧反应的热化学方程式:____________。
(5)ZX的电子式为____________;ZX与水反应放出气体的化学方程式为____________。
(6)熔融状态下,Z的单质和FeG2能组成可充电电池(装置示意图如下),反应原理为:2Z+FeG2 Fe+2ZG
Fe+2ZG
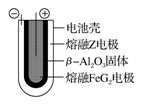
放电时,电池的正极反应式为____________;充电时,______ ______(写物质名称)电极接电源的负极:该电池的电解质为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
短周期元素W、X、Y和Z的原子序数依次增大。元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是
A. 元素W、X的氯化物中,各原子均满足8电子的稳定结构
B. 元素X与氢形成的原子比为1:1的化合物有很多种
C. 元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成
D. 元素Z可与元素X形成共价化合物XZ2
查看答案和解析>>
科目:高中化学 来源: 题型:
金属钙线是炼制优质钢材的脱氧脱磷剂,某钙线的主要成分为金属M和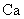 ,并含有3.5%(质量分数)
,并含有3.5%(质量分数)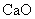 .
.
(1)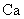 元素在周期表中位置是 ,其原子结构示意图 .
元素在周期表中位置是 ,其原子结构示意图 .
(2)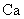 与最活跃的非金属元素A形成化合物D,D的电子式为 ,D的沸点比A与
与最活跃的非金属元素A形成化合物D,D的电子式为 ,D的沸点比A与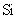 形成的化合物E的沸点 .
形成的化合物E的沸点 .
(3)配平用钙线氧脱鳞的化学方程式:
P+ FeO+ CaO
 + Fe
+ Fe
(4)将钙线试样溶于稀盐酸后,加入过量 溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色
溶液,生成白色絮状沉淀并迅速变成灰绿色,最后变成红褐色 .则金属M为______;检测
.则金属M为______;检测 的方法是_____(用离子方程式表达).
的方法是_____(用离子方程式表达).
(5)取1.6g钙线试样,与水充分反映,生成224ml. (标准状况),在想溶液中通入适量的
(标准状况),在想溶液中通入适量的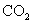 ,最多能得到
,最多能得到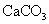 g.
g.
查看答案和解析>>
科目:高中化学 来源: 题型:
下列关于元素周期表和元素周期律的说法错误的是
A.Li、Na、K元素的原子核外电子层数随着核电荷数的增加而增多
B.第二周期元素从Li到F,非金属性逐渐增强
C.因为Na比K容易失去电子,所以Na比K的还原性强
D.O与S为同主族元素,且O比S的非金属性强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com