
【题目】氨氮废水中的氮元素多以NH4+和NH3H2O的形式存在,在一定条件下,NH4+经过两步反应被氧化成NO3﹣ , 两步反应的能量变化示意图如图所示: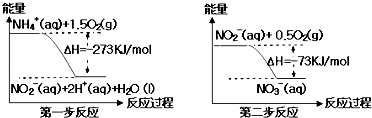
下列说法合理的是( )
A.该反应的催化剂是NO2﹣
B.升高温度,两步反应速率均加快,有利于NH4+ 转化成NO3﹣
C.在第一步反应中,当溶液中水的电离程度不变时,该反应即达平衡状态
D.1 mol NH4+在第一步反应中与1 mol NO2﹣在第二步反应中失电子数之比为1:3
【答案】C
【解析】A、NO2﹣在第一步反应中是生成物,在第二步反应中是反应物,为中间产物,不符合催化剂的定义,A不符合题意;
B、分析两步反应可知:两步反应均为放热反应,升高温度,不利于NH4+转化成NO3﹣,B不符合题意;
C、第一步反应中有氢离子生成,氢离子存在抑制水的电离,当水的电离不变时,说明氢离子浓度不变,可说明此反应达到平衡状态,C符合题意;
D、NH4+ 转化成NO3﹣转移电子数为5﹣(﹣3)=8,NO2﹣转化为NO3﹣,转移电子数为5﹣(3)=2.转移电子数之比为4:1,D不符合题意;
所以答案是:C
【考点精析】本题主要考查了化学平衡状态的判断的相关知识点,需要掌握状态判断:①v(B耗)=v(B生)②v(C耗):v(D生)=x : y③c(C)、C%、n(C)%等不变④若A、B、C、D为气体,且m+n≠x+y,压强恒定⑤体系颜色不变⑥单位时间内某物质内化学键的断裂量等于形成量⑦体系平均式量恒定(m+n ≠ x+y)等才能正确解答此题.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】如图是批量生产的笔记本电脑所用的甲醇燃料电池的结构示意图。甲醇在催化剂作用下提供质子(H+)和电子,电子经外电路、质子经内电路到达另一极与氧气反应。电池总反应式为2CH3OH+3O2===2CO2+4H2O。下列说法中不正确的是

A. 左边的电极为电池的负极,a处通入的是甲醇
B. 每消耗3.2 g氧气转移的电子为0.4 mol
C. 电池负极的反应式为CH3OH+H2O6e===CO2+6H+
D. 电池的正极反应式为O2+2H2O+4e===4OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛(22Ti)铝合金在航空领域应用广泛,回答下列问题:
(1)基态Ti原子的核外电子排布式为[Ar]_____,其中s轨道上总共有______个电子。
(2)六氟合钛酸钾(K2TiF6)中存在[TiF6]2- 配离子,则钛元素的化合价是____,配位体____。
(3)TiCl3 可用作烯烃定向聚合的催化剂,例如丙烯用三乙基铝和三氯化钛做催化剂时,可以发生下列聚合反应: n CH3CH=CH2![]()
![]() ,该反应中涉及的物质中碳原子的杂化轨道类型有_______________;反应中涉及的元素中电负性最大的是_________。三乙基铝是一种易燃物质,在氧气中三乙基铝完全燃烧所得产物中分子的立体构型是直线形的是____________。
,该反应中涉及的物质中碳原子的杂化轨道类型有_______________;反应中涉及的元素中电负性最大的是_________。三乙基铝是一种易燃物质,在氧气中三乙基铝完全燃烧所得产物中分子的立体构型是直线形的是____________。
(4)钛与卤素形成的化合物的熔沸点如下表所示,

分析TiCl4、TiBr4 、TiI4的熔点和沸点呈现一定规律的原因是___________________________。
(5)金属钛有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示是钛晶体的一种晶胞,晶胞参数a=0.295nm,c =0.469 nm,则该钛晶体的密度为 __________________ g·cm-3(用NA 表示阿伏伽德罗常数的值,列出计算式即可)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于元素周期表的说法正确的是( )
A.能生成碱的金属元素都在ⅠA族
B.原子序数为14的元素位于元素周期表的第3周期ⅣA族
C.稀有气体元素原子的最外层电子数均为8
D.第二周期ⅣA族元素的原子核电荷数和中子数一定为6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】砷(33As)在周期表中与氮同主族,砷及其化合物被运用在农药、除草剂、杀虫剂等。
(1)砷化氢的电子式为_________。
(2)成语“饮鸩止渴”中的“鸩”是指放了砒霜(As2O3)的酒。As2O3是一种两性氧化物,写出As2O3溶于浓盐酸的化学方程式_____________________。
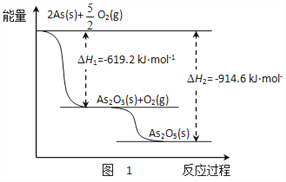
(3)砷的常见氧化物有As2O3和As2O5,其中As2O5热稳定性差。根据图1写出As2O5分解为As2O3的热化学方程式________________________________________。
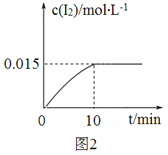
(4)砷酸钠(Na3AsO4)具有氧化性,298 K时,在100 mL烧杯中加入10 mL 0.1 mol/L Na3AsO4溶液、20 mL 0.1 mol/L KI溶液和20 mL 0.05 mol/L硫酸溶液,发生下列反应:AsO43-(无色)+2I-+2H+![]() AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
AsO33-(无色)+I2(浅黄色)+H2O ΔH。测得溶液中c(I2)与时间(t)的关系如图2所示(溶液体积变化忽略不计)。
①0~10 min内,I的反应速率v(I)=______________。
②在该条件下,上述反应的平衡常数K=__________。
③升高温度,溶液中AsO43-的平衡转化率减小,则该反应的ΔH______0(填“大于”“小于”或“等于”)。
(5)己知砷酸(H3ASO4)是三元酸,有较强的氧化性。
①常温下砷酸的Ka1=6×10-3、Ka2=1×10-7,则 NaH2AsO4溶液中c(HAsO42-)___c(H3AsO4)(填“>”、“<”或“=”)。
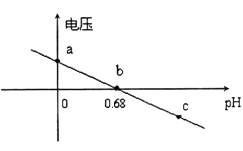
②某实验小组依据反应AsO43-+2H++2I-AsO33-+I2+H2O设计如图原电池,探究pH对AsO43-氧化性的影响.测得输出电压与pH的关系如图。则a点时,盐桥中K+____移动(填“向左”、“向右”或“不”),c点时,负极的电极反应为____________________。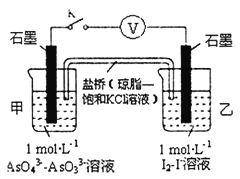
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 1H和2H是不同的核素,它们的质子数相同
B. 6Li和7Li的质子数相等,电子数也相等
C. 14C和14N的质量数相等,它们的中子数相等
D. 13C和14C属于同一种元素,它们的质量数相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温条件下,可逆反应:2NO(g)+O2(g)![]() 2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
2NO2(g)在体积固定的密闭容器中进行,达到平衡状态的标志的是( )
①单位时间内生成n mol O2的同时生成2n mol NO2②单位时间内生成n mol O2的同时生成2n mol NO③用NO2、NO、O2表示的反应速率的比为2:2:1的状态④混合气体的颜色不再改变的状态⑤混合气体的密度不再改变的状态⑥混合气体的压强不再改变的状态⑦混合气体的平均相对分子质量不再改变的状态.
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com