
【题目】已知某气态化石燃料X中只含有碳、氢两种元素,为探究该气体中碳和氢两种元素的质量比,某同学设计了燃烧法测量的实验方案,通过测量装置C和D的增重即可求得碳和氢两种元素的质量比.实验装置如下图所示![]() 已知CuO可以作为碳氢化合物燃烧的催化剂
已知CuO可以作为碳氢化合物燃烧的催化剂![]() :
:

(1)若A装置中所盛放的药品是浓NaOH溶液,装置A的作用有:
①______;
②______
(2)D装置中所盛放的药品是______,
(3)E装置的作用是______,
(4)上述装置中有一处缺陷,请改正______.
(5)若实验装置经过改正后,得到的实验数据如下:
质量 | 实验前 | 实验后 |
药品 |
|
|
药品 |
|
|
则该气体中碳和氢两种元素的质量比为______.
【答案】除去空气中的![]() 气体 调节X和空气的通入速率,保证
气体 调节X和空气的通入速率,保证![]() 过量 浓NaOH溶液 防止空气中的二氧化碳和水蒸气进入装置D,对结果产生影响 在A、B之间加一个盛浓硫酸的洗气瓶或盛无水
过量 浓NaOH溶液 防止空气中的二氧化碳和水蒸气进入装置D,对结果产生影响 在A、B之间加一个盛浓硫酸的洗气瓶或盛无水![]() 或
或![]() 、碱石灰、固体NaOH等
、碱石灰、固体NaOH等![]() 的干燥管 3:1
的干燥管 3:1
【解析】
(1)由于空气中含有CO2,会干扰燃烧产物CO2的吸收,所以必须利用氢氧化钠除去空气中的CO2。其次还可以利用A中气泡的产生的快慢来可知通入通入速率,以保证O2过量;
(2)D是吸收CO2的,所以盛放的试剂是浓NaOH溶液;
(3)由于空气中也含有水蒸气和CO2,所以E装置是吸收空气中的水和CO2的,因此试剂是碱石灰或固体NaOH;
(4)由于从A中出来的气体中一定含有水蒸气,会对后续的实验产生影响,所以需要在A和B之间加一个盛浓硫酸的洗气瓶或盛无水CaCl2(或P2O5、碱石灰、固体NaOH等)的干燥管;
(5)药品+U形管的质量/g增加1.8 g为生成水的质量,广口瓶D质量增加2.2g为燃烧生成二氧化碳气体的质量,物质的量分别是0.1mol水和0.05mol二氧化碳,计算得到碳和氢元素的质量之比.
(1) 由于空气中含有CO2,会干扰燃烧产物CO2的吸收,所以必须利用氢氧化钠除去空气中的CO2。其次还可以利用A中气泡的产生的快慢来可知通入通入速率,以保证O2过量;
故答案为:除去空气中的CO2气体;调节X和空气的通入速率,保证O2过量;
(2)D是吸收CO2的,所以盛放的试剂是浓NaOH溶液,故答案为:浓NaOH溶液;
(3)由于空气中也含有水蒸气和CO2,所以E装置是吸收空气中的水和CO2的,因此试剂是碱石灰或固体NaOH;
故答案为:防止空气中的二氧化碳和水蒸气进入装置D,对结果产生影响;
(4)由于从A中出来的气体中一定含有水蒸气,会对后续的实验产生影响,所以需要在A和B之间加一个盛浓硫酸的洗气瓶或盛无水CaCl2(或P2O5、碱石灰、固体NaOH等)的干管,
故答案为:在A.B之间加一个盛浓硫酸的洗气瓶或盛无水CaCl2(或P2O5、碱石灰、固体NaOH等)的干燥管;
(5)药品+U形管的质量/g增加1.8g为生成水的质量,广口瓶D质量增加2.2g为燃烧生成二氧化碳气体的质量,物质的量分别是0.1mol水和0.05mol二氧化碳,其中碳和氢元素的质量之比=0.05×12:0.1×2×1=3:1,
故答案为:3:1。


 新思维假期作业暑假吉林大学出版社系列答案
新思维假期作业暑假吉林大学出版社系列答案 蓝天教育暑假优化学习系列答案
蓝天教育暑假优化学习系列答案科目:高中化学 来源: 题型:
【题目】下列热化学方程式中ΔH能表示可燃物燃烧热的是( )
A.2H2(g) + O2(g) = 2H2O(g) ΔH= -483.6kJ·mol-1
B.CO(g) +![]() O2(g) = CO2(g) ΔH= -283kJ·mol-1
O2(g) = CO2(g) ΔH= -283kJ·mol-1
C.CH4(g) + 2O2(g) = CO2(g) +2H2O(g) ΔH= -802kJ·mol-1
D.C(s) +![]() O2(g) = CO(g) ΔH= -108kJ·mol-1
O2(g) = CO(g) ΔH= -108kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应①:CO(g)+CuO(s) CO2(g)+Cu(s)和反应②:H2(g)+CuO(s) Cu(s)+H2O(g)在相同的某温度下的平衡常数分别为K1和K2该温度下反应③:CO(g)+H2O(g) CO2(g)+H2(g)的平衡常数为K。则下列说法正确的是( )
A.反应①的平衡常数K1=![]()
B.对于反应③,恒容时,温度升高,H2浓度减小,则K变大
C.反应③的平衡常数K=![]()
D.对于反应③,恒温恒容下,增大压强,H2浓度一定减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是 ( )
A.0.1 mol/LNa2CO3的溶液中:c(![]() )=2c(H2CO3)+c(H+)- c(OH-)
)=2c(H2CO3)+c(H+)- c(OH-)
B.物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)=2c(![]() )+2c(
)+2c(![]() )+2c(H2CO3)
)+2c(H2CO3)
C.向3.0 L 0.1 mol·L-1 NaOH溶液中缓慢通入CO2至溶液增重8.8 g时,溶液中: c(Na+)>c(![]() )>c(
)>c(![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
D.等物质的量的CH3COOH、CH3COONa混合溶液pH=4.75中:c(CH3COO-)+c(OH-)>c(CH3COOH)+c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在不同温度下按照相同物质的量投料发生反应:CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g) ![]() H<0,测得CO的平衡转化率与压强的关系如图所示,有关说法正确的是 ( )
H<0,测得CO的平衡转化率与压强的关系如图所示,有关说法正确的是 ( )
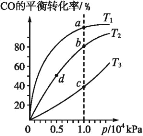
A.反应温度:T1>T2>T3
B.正反应速率:v 正(d)=v 正(b)
C.混合气体密度:ρ(a)>ρ(b)
D.混合气体平均摩尔质量:M(b)<M(c)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】大力发展电动汽车,可以有效控制空气污染。目前机动车常使用的电池有铅蓄电池、锂电池等。
I.铅蓄电池充放电的总反应为:PbO2+Pb+2H2SO4![]() 2PbSO4+2H2O。锂硫电池充放电的总反应为:2Li+S
2PbSO4+2H2O。锂硫电池充放电的总反应为:2Li+S![]() Li2S。
Li2S。
(1)铅蓄电池的负极材料为________________________。
(2)当消耗等质量的负极活性物质时,锂硫电池的理论放电量是铅蓄电池的___________倍。(保留三位有效数字)
II.由方铅矿(PbS)制备铅蓄电池电极材料(PbO2)的方法如下:

(3)步骤①酸溶时,为提高酸溶速率,可采取的措施是____________ (任写一条)。
(4)已知 25℃时,Ksp(PbSO4)=1.82×10-8,Ksp(PbCO3)=1.46×10-13。若步骤②沉铅后的滤液中c(Pb2+)=1.82×10-6 mol·L-1,则此时c(![]() )=_____________ mol·L-1。
)=_____________ mol·L-1。
(5)步骤③向PbSO4中加Na2CO3溶液会发生:PbSO4(s)+![]() (aq)=PbCO3(s)+
(aq)=PbCO3(s)+![]() (aq)。列式并计算该反应此温度下的平衡常数K=______________(写出K的表达式、代入数据、算出结果、保留三位有效数字)
(aq)。列式并计算该反应此温度下的平衡常数K=______________(写出K的表达式、代入数据、算出结果、保留三位有效数字)
(6)以石墨为电极电解Pb(NO3)2溶液也可以制得PbO2。PbO2将在__________极生成(填“阴”或“阳”);而另一极存在电极反应Pb2++2e-=Pb,故Pb元素的利用率较低。若在Pb(NO3)2溶液中加入适量Cu(NO3)2则可有效利用Pb2+,其理由是_____________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】烯烃M的分子式为C4H8.其结构中无支链且含有两种不同化学环境的氢,下列关于M的说法错误的是( )
A.M中所有碳原子一定共面B.M可发生氧化反应,还原反应和聚合反应
C.M与HCl的加成产物只有一种D.M的同分异构体(不含M)中属于烯烃的有4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】100℃时,将![]() 置于1L密闭的烧瓶中,烧瓶内的气体逐渐变为红棕色:
置于1L密闭的烧瓶中,烧瓶内的气体逐渐变为红棕色:![]() ,下列结论能说明上述反应在该条件下已经达到平衡状态的有几个( )
,下列结论能说明上述反应在该条件下已经达到平衡状态的有几个( )
①![]() 的消耗速率与
的消耗速率与![]() 的生成速率之比为1:2
的生成速率之比为1:2
②![]() 生成速率与
生成速率与![]() 消耗速率相等
消耗速率相等
③烧瓶内气体的压强不再变化
④烧瓶内气体的质量不再变化
⑤![]() 的物质的量浓度不再改变
的物质的量浓度不再改变
⑥烧瓶内气体的颜色不再加深
⑦烧瓶内气体的平均相对分子质量不再变化
⑧烧瓶内气体的密度不再变化
A.3个B.4个C.5个D.6个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是部分短周期元素原子半径与原子序数的关系图。下列说法正确的是
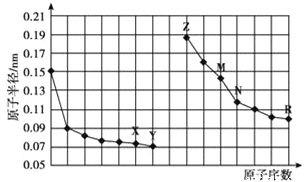
A.![]() 一定不与酸反应
一定不与酸反应
B.![]() 与水反应时,水是还原剂
与水反应时,水是还原剂
C.简单离子的半径:![]()
D.最高价氧化物对应水化物的碱性:![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com