
【题目】100℃时,将![]() 置于1L密闭的烧瓶中,烧瓶内的气体逐渐变为红棕色:
置于1L密闭的烧瓶中,烧瓶内的气体逐渐变为红棕色:![]() ,下列结论能说明上述反应在该条件下已经达到平衡状态的有几个( )
,下列结论能说明上述反应在该条件下已经达到平衡状态的有几个( )
①![]() 的消耗速率与
的消耗速率与![]() 的生成速率之比为1:2
的生成速率之比为1:2
②![]() 生成速率与
生成速率与![]() 消耗速率相等
消耗速率相等
③烧瓶内气体的压强不再变化
④烧瓶内气体的质量不再变化
⑤![]() 的物质的量浓度不再改变
的物质的量浓度不再改变
⑥烧瓶内气体的颜色不再加深
⑦烧瓶内气体的平均相对分子质量不再变化
⑧烧瓶内气体的密度不再变化
A.3个B.4个C.5个D.6个
【答案】C
【解析】
①无论反应是否达到平衡状态,N2O4的消耗速率与NO2的生成速率之比都为1:2,所以不能证明是否达到平衡状态,故①错误;
②NO2表示的正逆反应速率相等,所以能证明达到平衡状态,故②正确;
③该反应是反应前后气体体积改变的反应,当该反应达到平衡状态时,各物质的物质的量不再改变,所以压强就不再改变,能证明该反应达到平衡状态,故③正确;
④根据质量守恒,无论该反应是否达到平衡状态,混合气体的质量都不改变,所以不能证明该反应是否达到平衡状态,故④错误;
⑤平衡时各种物质的物质的量、浓度等不再发生变化,所以能证明该反应达到平衡状态,故⑤正确;
⑥平衡时各种物质的物质的量、浓度等不再发生变化,烧瓶内气体的颜色不再加深,所以能证明该反应达到平衡状态,故⑥正确;
⑦平衡时各种物质的物质的量、浓度等不再发生变化,质量始终不变,所以当烧瓶内气体的平均相对分子质量不再变化时,能证明该反应达到平衡状态,故⑦正确;
⑧根据质量守恒,反应前后气体质量不变,容器的体积不变,所以烧瓶内气体的密度始终不变,故⑧错误;所以正确的有5个,故C正确。
故选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】人尿中可以分离出具有生长素效应的化学物质——吲哚乙酸,其结构简式如图所示。下列有关说法正确的是( )

A.吲哚乙酸分子中所有碳原子全部共面
B.吲哚乙酸苯环上的二氯代物共有四种
C.1 mol吲哚乙酸与足量氢气发生反应,最多消耗5 mol H2
D.吲哚乙酸可以发生取代反应、氧化反应和中和反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某气态化石燃料X中只含有碳、氢两种元素,为探究该气体中碳和氢两种元素的质量比,某同学设计了燃烧法测量的实验方案,通过测量装置C和D的增重即可求得碳和氢两种元素的质量比.实验装置如下图所示![]() 已知CuO可以作为碳氢化合物燃烧的催化剂
已知CuO可以作为碳氢化合物燃烧的催化剂![]() :
:

(1)若A装置中所盛放的药品是浓NaOH溶液,装置A的作用有:
①______;
②______
(2)D装置中所盛放的药品是______,
(3)E装置的作用是______,
(4)上述装置中有一处缺陷,请改正______.
(5)若实验装置经过改正后,得到的实验数据如下:
质量 | 实验前 | 实验后 |
药品 |
|
|
药品 |
|
|
则该气体中碳和氢两种元素的质量比为______.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NaCl和NaClO在酸性条件下可发生反应:![]() ,某学习小组拟研究消毒液
,某学习小组拟研究消毒液![]() 主要成分为NaCl和
主要成分为NaCl和![]() 的变质情况.
的变质情况.
(1)此消毒液中NaClO可吸收空气中的![]() 生成
生成![]() 和HClO而变质.写出化学反应方程式:______.
和HClO而变质.写出化学反应方程式:______.
(2)取适量消毒液放在试管中,加入足量一定浓度的硫酸,有气体放出.通过以下装置检验气体的成分,从而判断该消毒液是否变质.

限选试剂:![]() 浓硫酸、
浓硫酸、![]() 品红溶液、
品红溶液、![]() 淀粉溶液、
淀粉溶液、![]() 溶液、澄清石灰水、饱和NaCl溶液.
溶液、澄清石灰水、饱和NaCl溶液.
请完成下列实验方案.
所加试剂 | 预期现象和结论 |
向试管A中加足量① ______ ;试管B中加 | 若A中溶液变蓝色,B中溶液不褪色,C中溶液变浑浊,则消毒液部分变质;③ ______ ,则消毒液未变质; ④ ______ ,则消毒液完全变质. |
(3)测定消毒液中NaClO的浓度.实验步骤如下:
①量取![]() 消毒液放入锥形瓶中,加入过量的
消毒液放入锥形瓶中,加入过量的![]() 溶液
溶液![]() .
.
②定量分析.使![]() 的酸性
的酸性![]() 溶液和剩余的
溶液和剩余的![]() 发生反应.重复实验3次,测得平均消耗酸性
发生反应.重复实验3次,测得平均消耗酸性![]() 溶液
溶液![]() ;此过程中涉及的反应有:
;此过程中涉及的反应有:![]() ;
;![]()
③计算.消毒液中NaClO的浓度为______![]() 用含a、b、c、V的代数式表示
用含a、b、c、V的代数式表示![]() .
.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚氯乙烯是制作装修材料的最常用原料,失火时聚氯乙烯在不同的温度下,发生一系列复杂的化学变化,产生大量有害气体,其过程大体如图所示:

下列说法不正确的是( )
A.上述反应中①属于消去反应,④属于(脱氢)氧化反应
B.聚氯乙烯的单体可由乙烯与HCl加成而得
C.火灾中由聚氯乙烯产生的有害气体中含HCl、CO、C6H6等
D.在火灾现场,可以用湿毛巾捂住口鼻,并尽快远离现场
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室合成乙酸乙酯的步骤如下:在图甲的圆底烧瓶内加入乙醇、浓硫酸和乙酸,加热回流一段时间,然后换成图乙装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。(加热和夹持装置省略)

请回答下列问题:
(1)乙醇、浓硫酸和乙醇三种反应物的加入顺序是___________________,在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入_________________;图甲中冷凝水从_______________(a或b)进。
(2)现报分离粗产品乙酸乙酯、乙酸和乙醇的混合物下列框图是分离操作步骤流程:
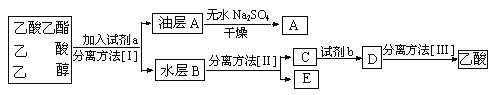
则试剂a是:___________________,分离方法Ⅰ是___________________,分离方法Ⅲ是___________________,试剂b是___________________(A、浓HCI B、浓H2SO4 C、浓HNO3)。
(3)甲、乙两位同学欲将所得含有乙醇、乙酸和水的乙酸乙酯粗产品提纯得到乙酸乙酯,在未用指示剂的情况下,他们都是先加NaOH溶液中和酯中过量的酸,然后用蒸馏法将酯分离出来。甲、乙两人蒸馏产物结果如下:甲得到了显酸性的酯的混合物,乙得到了大量水溶性的物质,丙同学分析了上述实验目标产物后认为上述实验没有成功。试解答下列问题:
①甲实验失败的原因是:_________________________________________________________;
②乙实验失败的原因是:_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.HF在水溶液中的电离方程式:HF+H2O![]() F-+H3O+
F-+H3O+
B.向0.1 mol·L-1氨水中加入少量水,溶液中![]() 减少
减少
C.将NH4Cl溶液从20℃升温至30℃,溶液中![]() 增大
增大
D.CH3COOK水解的离子方程式:CH3COO-+H2O=CH3COOH+OH-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在t℃时,某NaOH稀溶液中,c(H+)=10﹣amolL﹣1,c(OH﹣)=10﹣bmolL﹣1,已知a+b=12,则:
(1)该温度下水的离子积常数KW=_______;
(2)该NaOH溶液的物质的量浓度的精确值是______molL﹣1;
(3)在该温度下,将100mL 0.1molL﹣1的稀硫酸与100mL 0.4molL﹣1的NaOH溶液混合后,溶液的pH=______;
(4)该温度下若100体积pH1=a的某强酸溶液与1体积pH2=b的某强碱溶液混合后溶液呈中性,则混合前 a与b之间应满足的关系是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(有毒性,市场上很易与食盐混淆)是一种常见的工业用盐,广泛用于物质合成、金属表面处理等,它的性质或用途,其物理性质与NaCl极为相似.相关化学性质如图所示,下列说法不正确的是( )

A. NaNO2稳定性大于NH4NO2 B. NaNO2与N2H4反应中,NaNO2是氧化剂
C. 可用KI淀粉和食醋鉴别NaNO2和NaCl D. 分解NaN3盐每产生1mol N2转移6mole-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com