
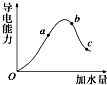
 一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:
一定温度下,冰醋酸加水稀释过程中溶液的导电能力变化曲线如图所示,请回答:

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑥⑧ | B、③⑦⑧ |
| C、②⑤⑥⑦ | D、①④⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、中和此溶液所需的0.1 mol?L-1 NaOH溶液的体积增加 |
| B、c(CH3COOH)减小,平衡向电离方向移动,c(CH3COO-)增大 |
| C、平衡向电离方向移动,c(CH3COOH)、c(H+)、c(OH-)、c(CH3COO-)均减小 |
| D、电离程度增大,由CH3COOH电离出的n(H+)变大 |
查看答案和解析>>
科目:高中化学 来源: 题型:
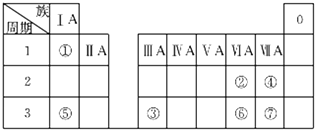
查看答案和解析>>
科目:高中化学 来源: 题型:
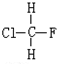 与
与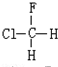
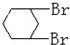 与
与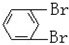
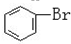 与
与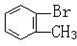
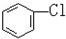 与
与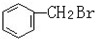
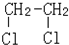 与CH3-CH2Cl.
与CH3-CH2Cl.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、原子半径的大小顺序:r(Y)>r(Z)>r(W) |
| B、只含X、Y、Z三种元素的化合物,可能是离子化合物,也可能是共价化合物 |
| C、元素Y的简单气态氢化物的热稳定性比Z的强 |
| D、元素Z、W的简单离子的电子层结构不同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com