
| 4 |
| 4 |
| ||
| ||
| 4 |
| 4 |
| ||
| ||
|
| a |
| 442 |
| a |
| 442 |
| a |
| 442 |
| 3a |
| 442 |
| 3a |
| 442 |


 口算题天天练系列答案
口算题天天练系列答案科目:高中化学 来源: 题型:
| A、同周期元素中X的金属性最强 |
| B、同周期元素中Y的最高价含氧酸的酸性最强 |
| C、原子半径X>Y,离子半径X+>Z2- |
| D、同族元素中Z的氢化物稳定性最高 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、 I2(g)+H2(g)?2HI(g) |
B、 CH3COOH?H++CH3COO-(忽略溶液体积变化) |
C、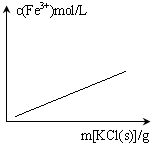 FeCl3+3KSCN?Fe(SCN)3+3KCl(忽略液体体积变化) |
D、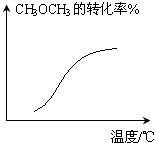 CH3OCH3(g)+3H2O(g)?6H2(g)+2CO(g)-Q(恒压) |
查看答案和解析>>
科目:高中化学 来源: 题型:
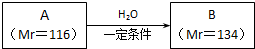
查看答案和解析>>
科目:高中化学 来源: 题型:
| 选项 | W | X | Y | Z |
| A | CH3COOC2H5 | CH3COOH | Na2CO3溶液 | 分液 |
| B | CO2 | SO2 | 饱和Na2CO3溶液 | 洗气 |
| C | NaCl固体 | I2 | CCl4 | 分液 |
| D | Na2CO3溶液 | NaHCO3溶液 | Ca(OH)2溶液 | 过滤 |
| A、A | B、B | C、C | D、D |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、7.1g氯气与足量的氢氧化钠溶液反应转移的电子数为0.2×6.02×1023 |
| B、V L a mol?L-1的氯化铁溶液中,若Fe3+的数目为6.02×1023,则Cl-的数目大于3×6.02×1023 |
| C、工业用电解法进行粗铜精炼时,每转移1mol电子,阳极上溶解的Cu数必为0.5×6.02×1023 |
| D、标准状况下,22.4LNO和11.2L O2混合后气体的分子总数为1.0×6.02×1023 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com