
【题目】25℃,向40 mL 0.05 mol/L的FeCl3溶液中加入10 mL 0.15 mol/L的KSCN溶液,发生反应,混合溶液中c(Fe3+)与反应时间(t)的变化如图所示。

(1)该反应的离子方程式为:_________________;
(2)E点对应的坐标为(0,____),t1~t2段v(SCN-)=______mol/(L.min)(用相应字母表示);
(3)关于A、B、C、D四点,下列说法正确的是____________(填序号)
①A点处Fe3+的消耗速率小于B点处Fe(SCN)3的消耗速率
②平均反应速率最小的时间段是t2~t3段
③D点处c(Fe3+)/c[Fe(SCN)3]比值不变
④t4时向溶液中加入50 mL 0.1 mol/L KCl溶液,平衡逆向移动
(4)该反应的平衡常数K值=___________________。
【答案】 Fe3+ + 3SCN - ![]() Fe(SCN)3 0.04
Fe(SCN)3 0.04 ![]() ③④ K=
③④ K= ![]()
【解析】试题分析:(1)Fe3+与SCN –生成Fe(SCN)3;(2)40 mL 0.05 mol/L的FeCl3溶液中加入10 mL 0.15 mol/L的KSCN溶液,溶液总体积变为50 mL;根据![]() 计算v(SCN-);(3)①达到平衡前,正反应速率大于逆反应速率;② 根据
计算v(SCN-);(3)①达到平衡前,正反应速率大于逆反应速率;② 根据![]() ,浓度变化越小,速率越小;③ D是平衡状态;④ t4时向溶液中加入50 mL 0.1 mol/L KCl溶液,Q减小,K不变;(4)利用“三段式”计算反应的平衡常数。
,浓度变化越小,速率越小;③ D是平衡状态;④ t4时向溶液中加入50 mL 0.1 mol/L KCl溶液,Q减小,K不变;(4)利用“三段式”计算反应的平衡常数。
解析:(1)Fe3+与SCN –生成Fe(SCN)3,离子方程式是Fe3+ + 3SCN - ![]() Fe(SCN)3;(2)40 mL 0.05 mol/L的FeCl3溶液中加入10 mL 0.15 mol/L的KSCN溶液,溶液总体积变为50 mL,所以Fe3+的初始浓度是
Fe(SCN)3;(2)40 mL 0.05 mol/L的FeCl3溶液中加入10 mL 0.15 mol/L的KSCN溶液,溶液总体积变为50 mL,所以Fe3+的初始浓度是![]() ;SCN -的初始浓度是0.15 mol/L
;SCN -的初始浓度是0.15 mol/L![]() =0.03 mol/L;t1~t2段Fe3+的浓度变化是(n-p) mol/L,根据Fe3+ + 3SCN -
=0.03 mol/L;t1~t2段Fe3+的浓度变化是(n-p) mol/L,根据Fe3+ + 3SCN - ![]() Fe(SCN)3,t1~t2段SCN -的浓度变化是3(n-p) mol/L ,根据
Fe(SCN)3,t1~t2段SCN -的浓度变化是3(n-p) mol/L ,根据![]() ,v(SCN-)=
,v(SCN-)=![]() ;(3)①达到平衡前,正反应速率大于逆反应速率,A点处Fe3+的消耗速率大于B点处Fe(SCN)3的消耗速率,故①错误;② 根据
;(3)①达到平衡前,正反应速率大于逆反应速率,A点处Fe3+的消耗速率大于B点处Fe(SCN)3的消耗速率,故①错误;② 根据![]() ,浓度变化越小,速率越小,平均反应速率最小的时间段是t3~t4段;③ D是平衡状态,各离子浓度保持不变,所以c(Fe3+)/c[Fe(SCN)3]比值不变,故③正确;④ t4时向溶液中加入50 mL 0.1 mol/L KCl溶液,Q减小,K不变,Q<K平衡逆向移动,故④正确;
,浓度变化越小,速率越小,平均反应速率最小的时间段是t3~t4段;③ D是平衡状态,各离子浓度保持不变,所以c(Fe3+)/c[Fe(SCN)3]比值不变,故③正确;④ t4时向溶液中加入50 mL 0.1 mol/L KCl溶液,Q减小,K不变,Q<K平衡逆向移动,故④正确;
(4)
平衡常数K=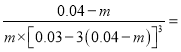
![]() 。
。


 培优好卷单元加期末卷系列答案
培优好卷单元加期末卷系列答案科目:高中化学 来源: 题型:
【题目】 NA为阿伏伽德罗常数,下列说法正确的是
A.18gD2O和18gH2O中含有的质子数均为10NA
B.高温下,0.2 mol Fe与足量水蒸气反应,生成的H2分子数目为0.3NA
C.欲配制1.00L 1.00mol·L-1的NaCl溶液,可将58.5g NaCl溶于1.00L水中
D.过氧化钠与水反应时,生成0.1mol氧气转移的电子数为0.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A.一定条件下向容积为1L的密闭容器内通入46gNO2,则NO2的物质的量浓度一定为1mol/L
B.标准状况下,22.4L的己烷中有20×6.02×1023个原子
C.1mol氯气溶于水转移6.02×1023个e-
D.0.1molCH5+含6.02×1023个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某反应的平衡常数表达式为:K=![]() 其平衡常数随温度变化如下表所示:请回答下列问题:
其平衡常数随温度变化如下表所示:请回答下列问题:
温度/℃ | 400 | 500 | 850 |
平衡常数 | 9.94 | 9 | K1 |
(1)该反应的ΔH______0(填“>”或“<”)。
(2)若在500 ℃时进行上述反应,某时刻测得四种物质的体积分数彼此相等,则此时反应_____向进行中(“正”或“逆”);
(3)850 ℃时在一个固定体(反应器中,投入2 molCO和3 molH2O(g),发生上述反应,CO和H2O(g)的浓度变化如图所示,则

①4 min时H2的物质的量分数=___________;②K1=_____________;
③若4分钟时测得反应的热效应数值为a kJ,则该反应的热化学方程式为:_________;
④若第6分钟将容器压缩为5L,画出6~8分钟CO的浓度变化图像(注明起点坐标)______________;
(4)t1℃(高于850℃)时,在相同容器中发生上述反应,容器内各物质的浓度随时间变化如下表。

①3~4min时,v正________v逆(填“>”或“=”或“<”),C1 ____0.08 mol/L(填“>”或“=”或“<”);
②反应在4 min~5 min,平衡向逆方向移动,可能的原因是_________ (单选),反应在5 min~6 min,平衡向正方向移动,可能的原因是___________ (单选)。
A.增加水蒸气 B.降低温度 C.使用催化剂 D.增加氢气浓度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室配制500 mL 0.2 mol/L的Na2SO4溶液,实验操作步骤有: a.在天平上称出14.2 g硫酸钠固体,把它放在烧杯中,用适量蒸馏水使它完全溶解并冷却至室温;
b.把制得的溶液小心转移至容量瓶中;
c.继续向容量瓶中加蒸馏水至液面距刻度线1~2 cm处,改用胶头滴管小心滴加蒸馏水至凹液面与刻度线相切;
d.用少量蒸馏水洗涤烧杯和玻璃棒2~3次,每次洗涤的液体都小心注入容量瓶,并轻轻振荡;
e.将容量瓶瓶塞塞紧,充分摇匀。
请填写下列空白:
(1)操作步骤的正确顺序为(填编号)。
(2)本实验用到的基本仪器已有烧杯、天平(带砝码)、镊子、玻璃棒,还缺少的仪器是、、。
(3)下列情况会使所配溶液浓度偏高的是(填编号)。  a.某同学观察液面的情况如右图所示
a.某同学观察液面的情况如右图所示
b.没有进行上述操作步骤D
c.加蒸馏水时,不慎超过了刻度线
d.砝码上沾有杂质
e.容量瓶使用前内壁沾有水珠
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L的密闭容器中,发生以下反应:2A(g)+ B(g) ![]() 2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
2C(g)+D(g) 。若最初加入的A和B都是4 mol,在前10秒钟A的平均反应速度为0.12 mol/(L·s),则10秒钟时,容器中B的物质的量是( )
A. 1.6 mol B. 2.8 mol C. 2.4 mol D. 1.2 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用一种阴、阳离子双隔膜三室电解槽处理废水中的![]() ,模拟装置如图所示。下列说法正确的是
,模拟装置如图所示。下列说法正确的是

A.阳极室溶液由无色变成棕黄色
B.阴极的电极反应式为4OH4e![]() 2H2O+O2↑
2H2O+O2↑
C.电解一段时间后,阴极室溶液中的pH升高
D.电解一段时间后,阴极室溶液中的溶质一定是(NH4)3PO4
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com