
【题目】以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
I. N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。
(1) 碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)2I(g)(快反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是__________。
A.N2O分解反应中:k值与是否含碘蒸气有关 B.第三步对总反应速率起决定作用
C.第二步活化能比第三步小 D.IO为反应的催化剂
Ⅱ.汽车尾气中含有较多的氮氧化物和不完全燃烧的CO,汽车三元催化器可以实现降低氮氧化物的排放量。汽车尾气中的NO(g)和CO(g)在催化剂的作用下转化成两种无污染的气体。如,
反应I:2CO +2NO N2+2CO2 △H1;反应II:4CO +2NO2 N2+4CO2 △H2<0。
(2) 针对反应I:
①已知:反应N2(g)+O2(g)2NO(g) △H3=+180.0kJ·mol1,若CO的燃烧热为-283.5kJ·moll 则反应I的△H1=_________kJ·mol1。
②若在恒容的密闭容器中,充入2molCO和1molNO,发生反应I,下列选项中不能说明该反应已经达到平衡状态的是_______。
A.CO和NO的物质的量之比不变 B.混合气体的密度保持不变
C.混合气体的压强保持不变 D.2v(N2)正=v(CO)逆
(3) 在2L密闭容器中充入2 mol CO和1 molNO2,发生上述反应II。
①若在某温度下,该反应达平衡时CO的转化率为40%,则该反应的平衡常数为________。
图 1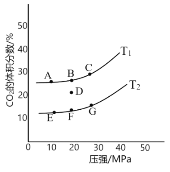 图 2
图 2 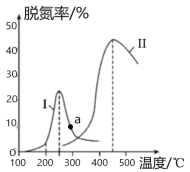
②图1为平衡时CO2的体积分数与温度、压强的关系。则温度:T1____T2(填“<”或“>”);若 在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的____点。
(4) 某研究小组探究催化剂对CO、NO2转化的影响。将NO2和CO以一定的流速通过两种不同的 催化剂进行反应,相同时间内测量逸出气体中NO2含量,从而确定尾气脱氮率(脱氮率即NO2的转化率),结果如图2所示。若高于450℃,图2中曲线中脱氮率随温度升高而降低的主要 原因是___________________________;a点 ______________(填“是”或“不是”)对应温度下的平衡脱氮率,说明理由____________________________________________________________。
【答案】A -747.0 kJ·mol1 B 0.22 L/mol < E 温度太高,催化剂的活性降低,反应放热,平衡向逆反应方向移动 不是 因为该反应为放热反应,根据线Ⅱ可知,a点对应温度的平衡脱氮率应该更高
【解析】
(1)A.由含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数),所以N2O分解反应中:k值与是否含碘蒸气有关,A正确;
B.第二步是慢反应,则第二步对总反应速率起决定作用,B错误;
C.第二步是慢反应,则第二步活化能比第三步大,C错误;
D.IO为反应的中间产物,不是催化剂,D错误;
答案选A。
(2)①CO的燃烧热为-283.5kJ·moll,则2CO(g)+O2(g)=CO2(g) △H=-567 kJ·moll,又因为N2(g)+O2(g)=2NO(g) △H3=+180.0kJ·mol1,则两式想减即得到反应I的△H1=-747.0 kJ·mol1。
②A.起始时CO和NO的物质的量之比不满足化学计量数之比,所以CO和NO的物质的量不变能说明反应达到平衡状态,A不选;
B.密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,因此混合气体的密度保持不变不能说明反应达到平衡状态,B选;
C.正反应体积减小,则混合气体的压强保持不变能说明反应达到平衡状态,C不选;
D.2v(N2)正=v(CO)逆说明正逆反应速率相等,D不选;
答案选B。
(3)① 4CO+2NO2![]() N2+4CO2
N2+4CO2
起始浓度(mol/L) 1 0.5 0 0
转化浓度(mol/L) 0.4 0.2 0.1 0.4
平衡浓度(mol/L)0.6 0.3 0.1 0.4
则该反应的平衡常数为![]() =0.22。
=0.22。
②正反应放热,升高温度平衡向逆反应方向进行,CO2体积分数减小,所以T1<T2;若在D点对反应容器升温的同时扩大体积使体系压强减小,由于正反应是体积减小的放热的可逆反应,则平衡向逆反应方向进行,所以重新达到的平衡状态可能是图中A~G点中的E点。
(4)由于温度太高,催化剂的活性降低,反应放热,平衡向逆反应方向移动,所以曲线中脱氮率随温度升高而降低;因为该反应为放热反应,根据线Ⅱ可知,a点对应温度的平衡脱氮率应该更高,所以a点不是对应温度下的平衡脱氮率。


 心算口算巧算一课一练系列答案
心算口算巧算一课一练系列答案科目:高中化学 来源: 题型:
【题目】柠檬烯是一种食用香料,其结构简式如图所示。下列有关柠檬烯的说法不正确的是( )
![]()
A. 它的核磁共振氢谱有8组吸收峰
B. 它的分子中所有的碳原子不可能在同一平面上
C. 它和丁基苯(![]() )互为同分异构体
)互为同分异构体
D. 一定条件下,它可以发生加成、取代、氧化等反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2在海洋中的转移和归宿,是当今海洋科学研究的前沿领域。溶于海水的CO2主要以4种无机碳形式存在,其中HCO3-占95%,在海洋循环中,通过下图所示的途径固碳。以下选项中相关说法不正确的是( )
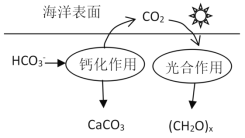
A.NaHCO3溶液中存在:c(H2CO3)+c(HCO3- )+c(OH-)=c(H+)
B.钙化作用的离子方程式为Ca2+ +2HCO3- ═CaCO3↓+CO2↑ + H2O
C.Na2CO3溶液中:c(Na+)>c(CO32-)>c(OH-)>c(HCO3- )>c(H+)
D.若将标况下2.24 L CO2气体通入足量的NaOH溶液,所得溶液中存在:n(H2CO3)+n(HCO3- )+n(CO32-)=0.1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Mg(OH)2固体在水中达到溶解平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),为使Mg(OH)2固体的量减少,可加入少量的
Mg2+(aq)+2OH-(aq),为使Mg(OH)2固体的量减少,可加入少量的
A. NH4Cl B. NaOH C. MgSO4 D. Na2SO4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】物质的类别和核心元素的化合价是研究物质性质的两个重要角度。请根据如图所示,回答下列问题:

(1)Y的化学式为__________________
(2)气体X和气体Y混合产生淡黄色的烟,写出该反应的化学方程式________。
(3)欲制备Na2S2O3,从氧化还原角度分析,合理的是______(填序号)。
a.Na2S +S b.Na2SO3+S c.Na2SO3+Na2SO4 d.SO2+Na2SO4
(4)如图为铜丝与W的浓溶液反应并验证其产物性质的实验装置。

①反应①中体现的浓硫酸的化学性质是________。想要立即终止①的反应,最恰当的方法是__________。
a.上移铜丝,使其脱离溶液 b.撤去酒精灯 c.拔去橡胶塞倒出溶液
②装置④中品红溶液的作用是________,棉花团的作用__________。
③反应停止后,待装置冷却,把③取下后向其中加入氯水,观察到白色沉淀生成,写出相关反应的离子方程式__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:Ag++ SCN- = AgSCN↓(白色),某同学探究AgSCN的溶解平衡及转化,进行以下实验。

下列说法中,不正确的是
A. ①中现象能说明Ag+与SCN-生成AgSCN沉淀的反应有限度
B. ②中现象产生的原因是发生了反应Fe(SCN)3 + 3Ag+ = 3AgSCN↓+ Fe3+
C. ③中产生黄色沉淀的现象能证明AgI的溶解度比AgSCN的溶解度小
D. ④中黄色沉淀溶解的原因可能是AgI与KI溶液中的I-进一步发生了反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化镁纯品为无色单斜晶体,工业品通常呈黄褐色,有苦咸味。该物质可以形成六水合物,即六水氯化镁(MgCl2·6H2O),以下流程为由某混合物,制取纯净MgCl2·6H2O的生产过程:

已知:在本流程中,
Fe3+ | Fe2+ | Al3+ | Mg2+ | |
开始沉淀pH | 1.5 | 6.5 | 3.3 | 8.4 |
完全沉淀pH | 4.1 | 9.7 | 5.5 | 10.9 |
试回答下列问题:
(1)操作1所需玻璃仪器为____________________。
(2)流程中加入试剂2调节pH的范围是________;加入试剂2能形成沉淀的原因是___________________。
(3)操作3为加入足量的盐酸,然后经过___________、____________,过滤,洗涤,干燥;在操作不当的情况下,若MgCl2·6H2O受热则会发生水解形成碱式盐,则该反应的化学方程式为____________________。
(4)若25℃下,Ksp[Mg(OH)2]=4×10-12,则该温度下,将Mg(OH)2溶于水形成饱和溶液,则其饱 和溶液的pH=_________。(已知:lg5=0.7)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SNCR-SCR是一种新型的烟气脱硝技术(除去烟气中的NOx),其流程如下:

该方法中主要反应的热化学方程式为:4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) ΔH=-1646 kJ/mol,如图所示,反应温度会直接影响SNCR技术的脱硝效率。
4N2(g)+6H2O(g) ΔH=-1646 kJ/mol,如图所示,反应温度会直接影响SNCR技术的脱硝效率。
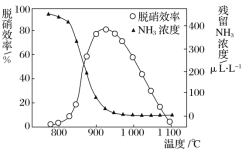
回答下列问题:
(1)SNCR技术脱硝的最佳温度选择925℃的理由是_______________________。
(2)SNCR与SCR技术相比,SNCR技术的反应温度较高,其原因是________________;
但当烟气温度高于1000℃时,SNCR脱硝效率明显降低,其原因可能是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA 为阿伏加德罗常数的值,下列说法不正确的是( )
A.0.l mol Cl2与足量的铁粉充分反应转移的电子数为 0.2 NA
B.1.0 mol CH4 与Cl2 在光照下反应生成的 CH3Cl 分子数为 1.0 NA
C.标准状况下,11.2 L甲烷和乙烯(C2H4)混合物中含氢原子数目为2 NA
D.0.1mol Cl2 通入水中,HClO、Cl-、ClO-粒子数之和小于 0.2 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com