
【题目】SNCR-SCR是一种新型的烟气脱硝技术(除去烟气中的NOx),其流程如下:

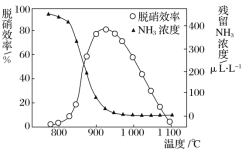
该方法中主要反应的热化学方程式为:4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) ΔH=-1646 kJ/mol,如图所示,反应温度会直接影响SNCR技术的脱硝效率。
4N2(g)+6H2O(g) ΔH=-1646 kJ/mol,如图所示,反应温度会直接影响SNCR技术的脱硝效率。
回答下列问题:
(1)SNCR技术脱硝的最佳温度选择925℃的理由是_______________________。
(2)SNCR与SCR技术相比,SNCR技术的反应温度较高,其原因是________________;
但当烟气温度高于1000℃时,SNCR脱硝效率明显降低,其原因可能是___________。
 轻松暑假总复习系列答案
轻松暑假总复习系列答案科目:高中化学 来源: 题型:
【题目】填写甲烷与氯气光照时的取代反应现象
(1)试管内气体________________________
(2)试管壁出现_________________________
(3)试管中有少量_________________________
(4)水面___________,但____________(填“充满”“ 不充满”)整个试管。
(5)产物中共有_______ 种,其中____________的结构是正四面体(写名称)写出第一步取代反应:______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NOx为主要成分的雾霾的综合治理是当前重要的研究课题。
I. N2O是一种强温室气体,且易形成颗粒性污染物,研究N2O的分解对环境保护有重要意义。
(1) 碘蒸气存在能大幅度提高N2O的分解速率,反应历程为:
第一步I2(g)2I(g)(快反应)
第二步I(g)+N2O(g)→N2(g)+IO(g)(慢反应)
第三步IO(g)+N2O(g)→N2(g)+O2(g)+I2(g)(快反应)
实验表明,含碘时N2O分解速率方程v=k·c(N2O)·[c(I2)]0.5(k为速率常数)。下列表述正确的是__________。
A.N2O分解反应中:k值与是否含碘蒸气有关 B.第三步对总反应速率起决定作用
C.第二步活化能比第三步小 D.IO为反应的催化剂
Ⅱ.汽车尾气中含有较多的氮氧化物和不完全燃烧的CO,汽车三元催化器可以实现降低氮氧化物的排放量。汽车尾气中的NO(g)和CO(g)在催化剂的作用下转化成两种无污染的气体。如,
反应I:2CO +2NO N2+2CO2 △H1;反应II:4CO +2NO2 N2+4CO2 △H2<0。
(2) 针对反应I:
①已知:反应N2(g)+O2(g)2NO(g) △H3=+180.0kJ·mol1,若CO的燃烧热为-283.5kJ·moll 则反应I的△H1=_________kJ·mol1。
②若在恒容的密闭容器中,充入2molCO和1molNO,发生反应I,下列选项中不能说明该反应已经达到平衡状态的是_______。
A.CO和NO的物质的量之比不变 B.混合气体的密度保持不变
C.混合气体的压强保持不变 D.2v(N2)正=v(CO)逆
(3) 在2L密闭容器中充入2 mol CO和1 molNO2,发生上述反应II。
①若在某温度下,该反应达平衡时CO的转化率为40%,则该反应的平衡常数为________。
图 1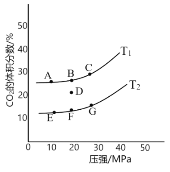 图 2
图 2 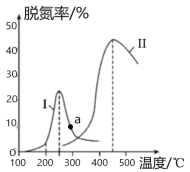
②图1为平衡时CO2的体积分数与温度、压强的关系。则温度:T1____T2(填“<”或“>”);若 在D点对反应容器升温的同时扩大体积使体系压强减小,重新达到的平衡状态可能是图中A~G点中的____点。
(4) 某研究小组探究催化剂对CO、NO2转化的影响。将NO2和CO以一定的流速通过两种不同的 催化剂进行反应,相同时间内测量逸出气体中NO2含量,从而确定尾气脱氮率(脱氮率即NO2的转化率),结果如图2所示。若高于450℃,图2中曲线中脱氮率随温度升高而降低的主要 原因是___________________________;a点 ______________(填“是”或“不是”)对应温度下的平衡脱氮率,说明理由____________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求回答下列问题:
(1)在200℃、101kPa时,0.5molH2(g)与足量I2(g)完全反应放出7.45kJ的热量,该反应的热化学方程式表示为____。
(2)根据键能数据估算
化学键 | C—H | C—F | H—F | F—F |
键能/(kJ·mol-1) | 414 | 489 | 565 | 155 |
CH4(g)+4F2(g) =CF4(g)+4HF(g)的反应热ΔH为______kJ/mol
(3) 已知:①2CH3OH(l)+3O2(g) =2CO2(g)+4H2O(g) ΔH1=-a kJ/mol
②C(s)+O2(g)=CO2(g) ΔH2=-b kJ/mol
③2H2(g) + O2(g) = 2H2O(g) ΔH3 = -c kJ/mol
a、b、c均大于0 则:反应①中,ΔS______(选填“>”、“<”或“=”)0;
2C(s)+4H2(g)+O2(g) = 2CH3OH(l) ΔH=_______kJ/mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用无机矿物资源生产部分材料的流程示意图如下。下列说法不正确的是( )

A. 在铝土矿制备较高纯度Al的过程中常用到NaOH溶液、CO2气体、冰晶石
B. 石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应
C. 在制粗硅时,被氧化的物质与被还原的物质的物质的量之比为2∶1
D. 黄铜矿(CuFeS2)与O2反应产生的Cu2S、FeO均是还原产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组探究SO2气体的还原性,装置如图所示,下列说法不合理的是
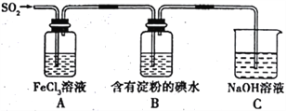
A. A装置中FeCl3溶液逐渐变为浅绿色,可以说明SO2有还原性
B. B装置中蓝色退去,说明还原性:SO2>I-
C. C装置中吸收尾气有可能倒吸
D. A、B装置中发生的反应转移电子数一定相等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某离子反应中涉及![]() 六种微粒,其中
六种微粒,其中![]() 的物质的量随时间变化的曲线如图所示。下列判断正确的是( )
的物质的量随时间变化的曲线如图所示。下列判断正确的是( )
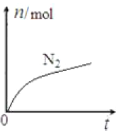
A.该反应的氧化剂是![]() ,还原产物是
,还原产物是![]() B.消耗
B.消耗![]() 还原剂,转移
还原剂,转移![]() 电子
电子
C.氧化剂与还原剂的物质的量之比为![]() D.水是生成物,且反应后溶液的酸性明显增强
D.水是生成物,且反应后溶液的酸性明显增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是一块非常独特的手表,用 H~Mg 12 种元素分别表示 1:00~12:00,关于此表的下列说法中不正确的是( )
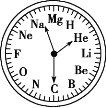
A.2:00 时的时针和 12:00 时的分针所指元素极难形成化合物
B.7:00 时,时针和分针所指元素可能形成相对分子质量为 100 的化合物
C.8:00 时,时针和分针所指元素形成的化合物属于碱性氧化物
D.3:00 时,时针所指元素的金属性比 11:00 时时针所指元素的金属性强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:25 ℃时, Kb(NH3·H2O)=1.8×10-5。 该温度下,用 0.100mol·L-1 的氨水滴定 10.00 mL 0.100mol·L-1 的一元酸 HA 的溶液, 滴定过程中加入氨水的体积(V)与溶液中 的关系如图所示。下列说法不正确的是

A. HA 为强酸
B. a=10
C. 25 ℃时,NH4+的水解平衡常数为![]()
D. 当滴入 20 mL 氨水时,溶液中存在 c(NH4+)>c(A-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com