
| A. | 容器内压强不随时间的延长而变化 | |
| B. | 单位时间内每消耗m个A分子的同时也生成了d个D分子 | |
| C. | 单位时间内每生成e个C分子的同时也生成了n个B分子 | |
| D. | A、B、C、D四种物质的分子数之比为m:n:e:d |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:A、因为反应前后气体的体积不知是否变化,所以混合气体的压强不随时间的延长而变化不能确定一定达到平衡状态,故A错误;
B、单位时间内每消耗m个A分子的同时也生成了d个D分子,都是指的正反应方向,故B错误;
C、单位时间内每生成e个C分子的同时也生成了n个B分子,则正逆反应速率相等,达化学平衡状态,故C正确;
D、从反应开始就符合v(A):v(B):v(C):v(D)=m:n:p:d,所以A、B、C、D四种物质的分子数之比一直为m:n:e:d,故D错误;
故选C.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 金属的电化学腐蚀比化学腐蚀更普遍 | |
| B. | 钢铁在干燥空气中不易被腐蚀 | |
| C. | 用铝质铆钉铆接铁板,铁板易被腐蚀 | |
| D. | 用牺牲锌块的方法来保护船身 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 FeSO4是一种精细化工产品,可用于治疗缺铁性贫血、制革、木材防腐等.制备步骤:①将3mol•L-1硫酸加入铁粉里,微热,搅拌使其充分反应;②趁热过滤;③在50℃左右蒸发、结晶,得到晶体--绿矾(FeSO4•7H2O).回答下列问题:
FeSO4是一种精细化工产品,可用于治疗缺铁性贫血、制革、木材防腐等.制备步骤:①将3mol•L-1硫酸加入铁粉里,微热,搅拌使其充分反应;②趁热过滤;③在50℃左右蒸发、结晶,得到晶体--绿矾(FeSO4•7H2O).回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | HClO+SO2+H2O═HCl+H2SO4:酸性 HClO>H2SO4 | |
| B. | Al2O3+2NaOH═2NaAlO2+H2O:Al2O3是两性氧化物 | |
| C. | NH3+H3O+═NH4++H2O:NH3结合H+的能力比H2O强 | |
| D. | 已知C(s,石墨)═C(s,金刚石)△H=+1.9 kJ/mol:金刚石比石墨稳定 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

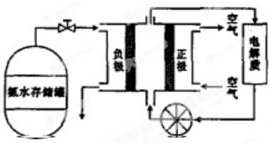
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 实验室中按照一定顺序混合2mL浓硫酸、3mL乙醇、2mL乙酸后加热制备乙酸乙酯,将产生的蒸汽经导管通到饱和碳酸钠溶液的液面上(如图所示).
实验室中按照一定顺序混合2mL浓硫酸、3mL乙醇、2mL乙酸后加热制备乙酸乙酯,将产生的蒸汽经导管通到饱和碳酸钠溶液的液面上(如图所示).查看答案和解析>>
科目:高中化学 来源: 题型:多选题
 取某稀硫酸和稀硝酸的混合溶液100mL.向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸被还原为NO气体).下列分析或结果正确的是( )
取某稀硫酸和稀硝酸的混合溶液100mL.向其中逐渐加入铁粉,产生气体的量随铁粉质量增加的变化如图所示(已知硝酸被还原为NO气体).下列分析或结果正确的是( )| A. | 最终溶液中所含的溶质为FeSO4 | |
| B. | OA段产生的气体是H2,BC段产生的气体是NO | |
| C. | 整个反应中转移电子数为1.2mol | |
| D. | 混合酸中NO3-的物质的量为0.2 mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com