
 Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.
Zn-MnO2干电池应用广泛,其电解质溶液是ZnCl2-NH4Cl混合溶液.分析 (1)锌锰原电池中负极材料为活泼金属Zn,MnO2为正极,电池工作时电子从负极经外电路流向正极;
(2)若ZnCl2-NH4Cl混合溶液中含有杂质Cu2+,锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀.除杂时不能引入新杂质,应选Zn将Cu2+ 置换为单质而除去;
(3)依据原电池原理和盐桥的作用,在同一烧杯中,电极与溶液含相同的金属元素,设计不同的电极为铜和锌,电解质溶液为硫酸铜和硫酸锌溶液;
从电硫稳定,能量转化彻底,反应速率快等分析判断;
解答 解:(1)负极上是失电子的,则Zn失电子为负极,电子由负极流向正极,故答案为:Zn(或锌); 正极;
(2)电化学腐蚀较化学腐蚀更快,锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀.题目中a和d选项不能除去杂质离子,c项会引入新杂质,所以应选Zn将Cu2+ 置换为单质而除去.故答案为:锌与还原出来的Cu构成铜锌原电池而加快锌的腐蚀;b;
(3)在同一烧杯中,电极与溶液含相同的金属元素,如图示设计原电池,锌做负极,铜做正极,原电池的甲装置示意图为: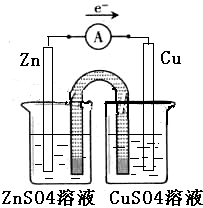
甲乙两种原电池中可更有效地将化学能转化为电能的是甲,因为甲可以保持电流稳定,化学能基本都转化为电能.而乙中的活泼金属还可以与CuSO4溶液发生置换反应,部分能量转化为热能,
故答案为: ;甲可以保持电流稳定,化学能基本都转化为电能;而乙中的活泼金属还可以与CuSO4溶液发生置换反应,部分能量转化为热能;
;甲可以保持电流稳定,化学能基本都转化为电能;而乙中的活泼金属还可以与CuSO4溶液发生置换反应,部分能量转化为热能;
点评 本题是将典型的实验知识与原电池原理、电解原理相融合的题型,涉及了电极材料分析、电解液净化及相关电化学计算等内容,具有较宽的知识覆盖面.学习中要电化学基础知识掌握扎实.


科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | MnO 2+4HCl(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ MnCl 2+Cl 2↑+2H 2O | |
| B. | K 2Cr 2O 7+6FeSO 4+7H 2SO 4═Cr 2(SO 4) 3+3Fe 2(SO 4) 3+K 2SO 4+7H 2O | |
| C. | 2Al+2NaOH+2H 2O═2NaAlO 2+3H 2↑ | |
| D. | 2KMnO 4+HCOOK+KOH═2K 2MnO 4+CO 2↑+H 2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,0.56 L丙烷中含有共价键的数目为0.2NA | |
| B. | 0.1 mol SO2与0.2 mol O2充分反应后可得到0.1NA个SO3分子 | |
| C. | 2.24 L 氯气与足量钠反应时转移电子数目为0.2NA | |
| D. | 0.1 mol乙烯和乙醇(蒸气)混合物完全燃烧所消耗的氧原子数一定为0.6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 容器内压强不随时间的延长而变化 | |
| B. | 单位时间内每消耗m个A分子的同时也生成了d个D分子 | |
| C. | 单位时间内每生成e个C分子的同时也生成了n个B分子 | |
| D. | A、B、C、D四种物质的分子数之比为m:n:e:d |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 某课外活动小组模拟工业制备纯碱,方案如下:
某课外活动小组模拟工业制备纯碱,方案如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 25 | B. | 20 | C. | 16 | D. | 9 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| 选项 | X | Y | Z | W |  |
| A | Cu[ | CuSO4[来 | Cu(OH)2 | CuO | |
| B | Na | NaOH | NaCl | NaHCO3 | |
| C | 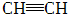 | CH2=CH2 | CH3CH3 | CH3CH2Cl | |
| D | Mg | MgO | MgSO4 | MgCl2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com