
 FeSO4��һ�־�ϸ������Ʒ������������ȱ����ƶѪ���Ƹľ�ķ����ȣ��Ʊ����裺�ٽ�3mol•L-1�������������ȣ�����ʹ���ַ�Ӧ���ڳ��ȹ��ˣ�����50�������������ᾧ���õ�����--�̷���FeSO4•7H2O�����ش��������⣺
FeSO4��һ�־�ϸ������Ʒ������������ȱ����ƶѪ���Ƹľ�ķ����ȣ��Ʊ����裺�ٽ�3mol•L-1�������������ȣ�����ʹ���ַ�Ӧ���ڳ��ȹ��ˣ�����50�������������ᾧ���õ�����--�̷���FeSO4•7H2O�����ش��������⣺���� ��1����������Ũ����һ�������·�����Ӧ����õ������������塢����������������������֮�䷴Ӧ�ɵõ�����������
��2�������Ӻ����軯�ػ�ϲ�����ɫ���ʣ������������Ӿ��л�ԭ�Ե����������м��飻
��3�����������������������ȷ���ᾧ�¶ȣ�
��4���ڿ����м����̷������ݹ��������ı仯����ϲ����������㣮
��� �⣺��1����������Ũ����һ�������·�����Ӧ����õ������������塢������������SO2����Ⱦ��������ӦʱҪ�����۹�������������������֮�䷴Ӧ�ɵõ�������������ֹ����Fe3+���ʴ�Ϊ������SO2����Ⱦ������ ��ֹ����Fe3+��
��2���������Ӿ��л�ԭ�ԣ����鷽����ȡ��������Һ���Թ��У�����KSCN��Һ�������Ա仯���ٵμ�������ˮ��Һ���ɫ���ʴ�Ϊ��ȡ��������Һ���Թ��У�����KSCN��Һ�������Ա仯���ٵμ�������ˮ��Һ���ɫ��
��3��Ϊ�˷�ֹ���������ᾧ���������ʧ������ʱ�����ȹ��ˣ��ʴ�Ϊ����ֹ���������ᾧ���������ʧ��
��4��FeS04•7H20��Ʒ���ʵ���=$\frac{55.6g}{278g/mol}$=0.2mol������m��H20��=1.4mol��18g/mol=25.2g��a���߱仯�У������������С10.8g��������ˮ10.8g������ʧȥ���ֽᾧˮ��������Ӧ��FeSO4•7H2O�TFeSO4•4H2O+3H2O�� ���������ױ�����Ϊ���������������ɲ�����Fe2O3��
�ʴ�Ϊ��FeSO4•7H2O�TFeSO4•4H2O+3H2O��Fe2O3��
���� ���⿼��ѧ���������Լ�����������ʣ���һ������ʵ�鷽�������Ŀ���ѶȽϴ�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | 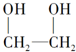 �� ��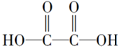 | B�� | 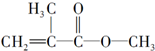 | ||
| C�� | 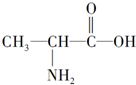 | D�� | C��CH3��4 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | MnO 2+4HCl��Ũ��$\frac{\underline{\;\;��\;\;}}{\;}$ MnCl 2+Cl 2��+2H 2O | |
| B�� | K 2Cr 2O 7+6FeSO 4+7H 2SO 4�TCr 2��SO 4�� 3+3Fe 2��SO 4�� 3+K 2SO 4+7H 2O | |
| C�� | 2Al+2NaOH+2H 2O�T2NaAlO 2+3H 2�� | |
| D�� | 2KMnO 4+HCOOK+KOH�T2K 2MnO 4+CO 2��+H 2O |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | Na2O��Mn2O7��Fe2O3������������ | |
| B�� | �ռ�Ǽʯ̿����ᡢ˫��ˮ����ˮ | |
| C�� | �������ˮ��Һ�еķ�Ӧ�������ӷ�Ӧ | |
| D�� | ���ʶ��л�ԭ�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ��״���£�0.56 L�����к��й��ۼ�����ĿΪ0.2NA | |
| B�� | 0.1 mol SO2��0.2 mol O2��ַ�Ӧ��ɵõ�0.1NA��SO3���� | |
| C�� | 2.24 L �����������Ʒ�Ӧʱת�Ƶ�����ĿΪ0.2NA | |
| D�� | 0.1 mol��ϩ���Ҵ����������������ȫȼ�������ĵ���ԭ����һ��Ϊ0.6NA |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�ѡ����
| A�� | ������ѹǿ����ʱ����ӳ����仯 | |
| B�� | ��λʱ����ÿ����m��A���ӵ�ͬʱҲ������d��D���� | |
| C�� | ��λʱ����ÿ����e��C���ӵ�ͬʱҲ������n��B���� | |
| D�� | A��B��C��D�������ʵķ�����֮��Ϊm��n��e��d |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ������
 ��
���鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com