
【题目】若乙酸分子中的氧都是18O,乙醇分子中的氧都是16O,二者在浓H2SO4作用下发生酯化反应,一段时间后,分子中含有18O的物质有
A.1种 B.2种 C.3种 D.4种
 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】现有a mol/L 的NaX和b mol/L的NaY两种盐溶液。下列说法正确的是
A.若a=b且c(X-)= c(Y-)+ c(HY),则HX为强酸
B.若a=b且pH(NaX)>pH(NaY),则c(X-)+ c(OH-)> c(Y-)+ c(OH-)
C.若a>b且c(X-)= c(Y-),则酸性HX>HY
D.若两溶液等体积混合,则c(Na+)=(a+b) mol/L(忽略混合过程中的体积变化)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知酸性K2Cr2O7溶液可与FeSO4反应生成Fe3+和Cr3+。现将硫酸酸化的K2Cr2O7溶液与FeSO4溶液混合,充分反应后再向所得溶液中加入KI溶液,混合溶液中Fe3+的物质的量随加入的KI的物质的量的变化关系如图所示,下列说法中不正确的是
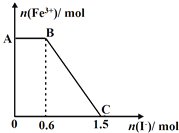
A.图中AB段的氧化剂为K2Cr2O7
B.图中BC段发生的反应为2Fe3++2I-=2Fe2++I2
C.开始加入的K2Cr2O7为0.25mol
D.K2Cr2O7可与FeSO4反应的物质的量为1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CaCO3与稀盐酸反应(放热反应)生成CO2的量与反应时间的关系如图所示。下列结论不正确的是
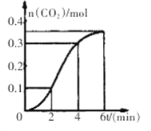
A.反应开始2分钟内平均反应速率最大
B.反应4分钟后平均反应速率最小
C.反应开始4分钟内温度对反应速率的影响比浓度大
D.反应4分钟后反应速率下降的原因是盐酸浓度逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用化学反应原理消除工业污染,保护生态环境具有非常重要的意义。
(1)采取热还原法,用碳粉可将氮氧化物还原。
已知:①N2(g)+O2(g)=2NO(g) △H=+180.6kJ·mol-1;
②C(s)+O2(g)=CO2(g) △H=-393.5kJ·mol-1。
则反应C(s)+2NO(g)=CO2(g)+N2(g) △H= kJ·mol-1。
(2)在催化剂作用下,将nmolSO2与nmolCl2充入容积可变的密闭容器中,发生反应:SO2(g)+ Cl2(g) ![]() SO2Cl2(g)(硫酰氯),并始终保持温度为T,压强为p。起始时气体总体积为10L,tmin时反应达到平衡状态,此时气体总体积为8L。
SO2Cl2(g)(硫酰氯),并始终保持温度为T,压强为p。起始时气体总体积为10L,tmin时反应达到平衡状态,此时气体总体积为8L。
①在容积改变的条件下,反应速率可用单位时间内反应物或生成物的物质的量变化来表示。则v(SO2)= ___ mol/min。
②此温度下,该反应的K= 。
③相同条件下,若将0.5nmolSO2与0.5nmolCl2充入该容器,到达平衡状态时,混合物中SO2Cl2的物质的量是 。
(3)利用氨水可以将SO2和NO2吸收,原理如图所示:
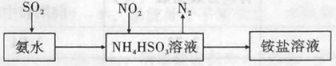
NO2被吸收的离子方程式是 。
(4)利用如下图所示装置(电极均为惰性电极)也可吸收SO2,并用阴极排出的溶液吸收NO2。
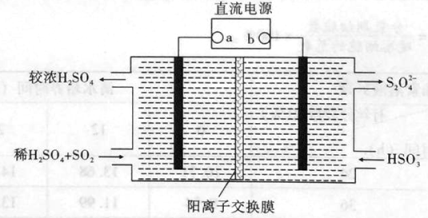
①阴极的电极反应式为 。
②在碱性条件下,用阴极排除的溶液吸收NO2,使其转化为无害气体,同时有SO32-生成。该反应的离子方程式为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是巨大的化学资源库,下列有关海水综合利用说法正确的是
A.海水的淡化,必须经过化学变化才能得到
B.海水蒸发制海盐的过程中只发生了化学变化
C.从海水中可以得到NaCl,电解熔融NaCl可制备金属Na
D.利用海水、铝、空气的航标灯的原理是将电能转化为化学能
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在溶液中能大量共存的一组离子或分子是
A.NH、H+、NO、HCO
B.Na+、CH3COO-、CO、OH-
C.Na+、K+、SO、Cl2
D.K+、Al3+、SO、NH3·H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com