
【题目】下列有机物可以形成顺反异构的是( )
A.丙烯
B.1﹣氯﹣1﹣丙烯
C.2﹣甲基﹣2﹣丁烯
D.2,3﹣二甲基﹣2﹣丁烯
科目:高中化学 来源: 题型:
【题目】低碳经济是以低能耗、低污染、低排放为基础的经济模式,低碳循环正成为科学家研究 的主要课题。最近有科学家提出构想:把空气吹 入饱和碳酸钾溶液,然后再把CO2从溶液中提取 出来,经化学反应后使之变为可再生燃料甲醇。 该构想技术流程如下:
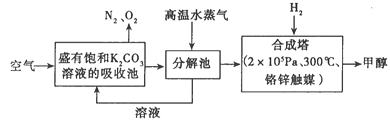
(1)向分解池中通入高温水蒸气的作用是________________。
(2)已知在常温常压下:
①2CH3OH(l)+3O2(g)=2CO2(g)+4H2O(g) △H=-1275.6 kJ·mol-1
②2CO(g)+O2(g)=2CO2(g) △H=-566.0 kJ·mol-1
③H2O(g)=H2O(l) △H=-44.0 kJ·mol-1
则甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为______________。
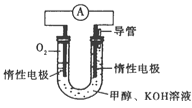
(3)依据甲醇燃烧的反应原理。设计如右图所示的电池装置。该装置负极的电极反应式为____________。
(4)已知Ksp(CaCO3)=2.8×10-9mol2·L-2.现将CaCl2溶液与0.02 mol·L-1Na2CO3溶液等体积混合,生成CaCO3沉淀时,所需CaCl2溶液的最小物质的量浓度为_____________。
(5)CO(g)和H2O(g)在一定条件下反应可得到清洁燃料H2。将不同量的CO(g)和H2O(g)分别通入到体积为2 L的恒容密闭容器中发生反应:CO(g)+H2O(g)=CO2(g)+H2(g),不同温度下得到三组数据:
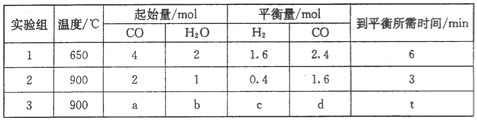
①实验1前6 min的反应速率v(CO2)=___________(保留小数点后两位,下同)。
②实验2条件下平衡常数K=_____________。
③该反应的△H____________0 (填“<”或“>”=。)
④实验3中,若平衡时的转化率α(CO)>α(H2O),则a/b的取值范围是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素的原子序数依次递增。已知:
①F的原子序数为29,其余均为短周期主族元素;
②A的内层电子总数是最外层电子数的一半;
③C、E同主族且C原子最外层电子数是次外层电子数的3倍;
④D是金属性最强的短周期元素。完成下列问题
(1)F在元素周期表的位置______________。
(2)B、C、D、E的原子半径由小到大顺序是_________ (用元素符号表示)。
(3)已知D在C的单质中燃烧生成淡黄色的固体化合物甲,甲的化学式为_______________,电子式为_______,甲中的化学键类型为____________________。
(4)A的单质与E的最高价含氧酸反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】t℃时Ag2CrO4在水中的沉淀溶解平衡曲线如图所示。下列说法正确的是( )
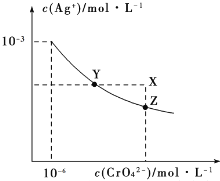
A.加热蒸发饱和Ag2CrO4溶液再恢复到t℃,可使溶液由Y点变到Z点
B.在X点没有Ag2CrO4沉淀生成,则此时温度低于t℃
C.向饱和Ag2CrO4溶液中加入少量AgNO3固体,可使溶液由Z点到Y点
D.在t℃时,Ag2CrO4的Ksp为1×10-9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.饮水安全在人们生活中占有极为重要的地位,某研究小组提取三处被污染的水源进行了分析,给出了如下实验信息:其中一处被污染的水源含有A、B两种物质,一处含有C、D两种物质,一处含有E物质。A、B、C、D、E五种常见化合物都是由下表中的离子形成:
阳离子 | K+ Na+ Cu2+ Al3+ |
阴离子 | SO42- HCO3- NO3- OH- |
为了鉴别上述化合物,分别进行以下实验,其结果如下所示:
①将它们溶于水后,D为蓝色溶液,其他均为无色溶液;②将E溶液滴入到C溶液中出现白色沉淀,继续滴加,沉淀溶解;③进行焰色反应,只有B、C为紫色(透过蓝色钴玻璃片);④在各溶液中加入硝酸钡溶液,再加过量稀硝酸,A中放出无色气体,C、D中产生白色沉淀;⑤将B、D两溶液混合,未见沉淀或气体生成。
根据上述实验填空:
(1)将含1 mol A的溶液与含1 mol E的溶液反应后蒸干,仅得到一种化合物,该化合物为____________。
(2)写出实验②发生反应的离子方程式: 。
(3)C常用作净水剂,用离子方程式表示其净水原理: 。
Ⅱ.某强酸性溶液X可能含有A13+、NH4+、Fe2+、Fe3+、CO32-、SO32-、SO42-、C1-中的若干种,取该溶液进行连续实验,实验过程及产物如下:
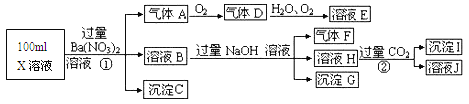
根据以上信息,回答下列问题:
(1)上述离子中,溶液X中除H+外还肯定含有的离子有_____________肯定不存在的离子是_________________
(2)请设计简单的实验检验不能确定是否含有的离子(若不止一种,可任选一种)的存在:____________________。
(3)写出反应①的离子方程式:________________。
(4)假设测定A、F、I均为0.1mol,100mL X溶液中n(H+)=0.4mol,当沉淀C的物质的量大于0.7mol时,溶液X中还一定含有____________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若乙酸分子中的氧都是18O,乙醇分子中的氧都是16O,二者在浓H2SO4作用下发生酯化反应,一段时间后,分子中含有18O的物质有
A.1种 B.2种 C.3种 D.4种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正丁醛经催化加氢可制备1-丁醇。为提纯含少量正丁醛杂质的1-丁醇,现设计如下路线:
![]()
已知:①正丁醛与饱和NaHSO3溶液反应可生成沉淀;②乙醚的沸点是34℃,难溶于水,与1-丁醇互溶;③1-丁醇的沸点是118℃。则操作1~4分别是( )
A.萃取、过滤、蒸馏、蒸馏 B.过滤、分液、蒸馏、萃取
C.过滤、蒸馏、过滤、蒸馏 D.过滤、分液、过滤、蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质的晶体中,化学键类型相同、晶体类型也相同的是( )
A. CO2和H2O B. CCl4和KCl C. NaCl和HCl D. SO2和SiO2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z是原子序数依次增大的同一短周期元素,W、X是金属元素,Y、Z是非金属元素。请回答下列问题:
(1)W、X各自的最高价氧化物对应的水化物可以反应生成盐和水,该反应的离子方程式为 。
(2)W与Y可形成化合物W2Y,该化合物的电子式为 。
(3)Y在周期表中的位置是 。
(4)比较W、X、Y、Z四种元素简单离子的半径大小(用化学式表示,下同): > > > ;比较Y、Z的气态氢化物稳定性强弱: > 。
(5)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为: 。
(6)Z的最高价氧化物为无色液体,0.25mol该物质与一定量水混合得到一种稀溶液,并放出Q kJ的热量,写出该反应的热化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com