
【题目】25 ℃时,水的电离达到平衡:H2O![]() H++OH-,下列叙述正确的是
H++OH-,下列叙述正确的是
A.将纯水加热到95 ℃时,Kw变大,pH不变,水仍呈中性
B.向纯水中加入稀氨水,平衡逆向移动,c(OH-)增大,Kw变小
C.向纯水中加入少量碳酸钠固体,影响水的电离平衡,c(H+)减小,Kw不变
D.向纯水中加入醋酸钠固体或盐酸,均可抑制水的电离,Kw不变
科目:高中化学 来源: 题型:
【题目】研究金属桥墩腐蚀及防护是跨海建桥的重要课题。下列有关判断中正确的是( )
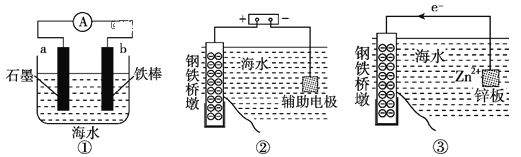
A.用装置①模拟研究时未见a上有气泡,说明铁没有被腐蚀
B.②中桥墩与外加电源正极连接能确保桥墩不被腐蚀
C.③中采用了牺牲阳极的阴极保护法保护桥墩
D.①②③中海水均是实现化学能与电能相互转化的电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】毒重石的主要成分 BaCO3(含 Ca2+、Mg2+、Fe3+等杂质),实验室利用毒重石制备 BaCl2·2H2O 的流程如下:
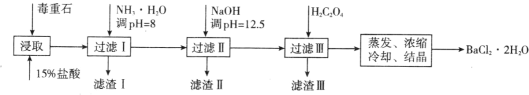
(1)毒重石用盐酸浸取前需充分研磨,目的是_______。实验室用 37%的盐酸配制 15%的盐酸,除量筒外还需使用下列仪器中的_______(填标号)。
a 烧杯 b 容量瓶 c 玻璃棒 d 滴定管
(2)
Ca2+ | Mg2 + | Fe3+ | |
开始沉淀时的 pH | 11.9 | 9.1 | 1.9 |
完全沉淀时的 pH | 13.9 | 11.1 | 3.2 |
流程中,滤渣Ⅱ中含_______(填化学式)。加入 H2C2O4 时应避免过量,原因是_______。 [已知:Ksp(BaC2O4)=1.6×10-7,Ksp(CaC2O4)=2.3×10-9]
(3)利用间接酸碱滴定法可测定 Ba2+的含量,实验分两步进行。已知:2CrO42-+2H+=Cr2O72-+H2O Ba2++CrO42-=BaCrO4↓
步骤Ⅰ:移取 xmL 一定浓度的 Na2CrO4 溶液与锥形瓶中,加入酸碱指示剂,用 b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸体积为 V0 mL。
步骤Ⅱ:移取 y mLBaCl2 溶液于锥形瓶中,加入 x mL 与步骤Ⅰ相同浓度的 Na2CrO4 溶液,待 Ba2+完全沉淀后,再加入酸碱指示剂,用b mol·L-1盐酸标准液滴定至终点,测得滴加盐酸的体积为 V1 mL。滴加盐酸标准液时应用酸式滴定管,“0”刻度位于滴定管的_______(填“上方”或“下方”)。BaCl2 溶液的浓度为___________mol·L-1,若步骤Ⅱ中滴加盐酸时有少量待测液溅出,Ba2+浓度测量值将_______(填“偏大”或“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度(T ℃)时,测得0.01 mol·L-1NaOH溶液的pH=11,则该温度下水的Kw=________。在此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合。
(1)若所得混合液为中性,且a=11,b=3,则Va∶Vb=__________。
(2)若所得混合液为中性,且Va∶Vb=10∶1,则a+b=__________。
(3)若所得混合液的pH=10,且a=12,b=2,则Va∶Vb=__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关下图装置中的叙述正确的是( )

A.Pt为正极,其电极反应为:O2+2H2O +4e-=4OH-
B.这是一个原电池装置,利用该装置可长时间的观察到Fe(OH)2 沉淀的颜色
C.这是电解NaOH溶液的装置
D.Fe为阳极,其电极反应为:Fe-2e-+2OH-=2Fe(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】温度为T1时,将气体X和气体Y各1.6mol充入10L恒容密闭容器中,发生反应X(g)+Y(g)![]() 2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:下列说法正确的是
2Z(g),一段时间后达到平衡。反应过程中测定的数据如表:下列说法正确的是
t/min | 2 | 4 | 7 | 9 |
n(Y)/mol | 1.2 | 1.1 | 1.0 | 1.0 |
A. 反应0~4 min的平均速率υ(Z)=0.25 mol/(Lmin)
B. T1时,反应的平衡常数K1=1.2
C. 其他条件不变,9 min后,向容器中再充入1.6 molX,平衡向正反应方向移动,再次达到平衡时X的浓度减小,Y的转化率增大
D. 其他条件不变,降温到T2达到平衡时,平衡常数K2=4,则此反应的△H<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图所示装置进行下列实验:将①中溶液滴入②中,预测的现象与实际相符的是
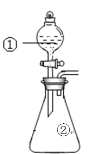
选项 | ①中物质 | ②中物质 | 预测②中的现象 |
A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
B. | 浓硝酸 | 用砂纸打磨过的铁片 | 产生红棕色气体 |
C. | 氯化铵溶液 | 氢氧化镁沉淀 | 白色沉淀溶解 |
D. | 碳酸氢钠溶液 | 苯酚钠溶液 | 溶液变浑浊 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列物质的溶液:①CH3COOH ②HCl ③H2SO4 ④NaHSO4
(1)若四种溶液的物质的量浓度相同,其c(H+)的大小比较为____________(用序号表示,下同)。
(2)将6 g CH3COOH溶于水制成1 L溶液,此溶液的物质的量浓度为___________,经测定溶液中c(CH3COO-)为1.4×10-3 mol/L,此温度下醋酸的电离常数Ka=____________,温度升高,Ka将_____(填“变大”“不变”或“变小”,下同),加入少量CH3COONa后c(H+)______,Ka______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上用钛白渣[主要成分为FeSO4,还含有少量Fe2(SO4)3、MgSO4及TiOSO4]为主要原料生产氧化铁黄(FeOOH)的一种工艺流程如下:
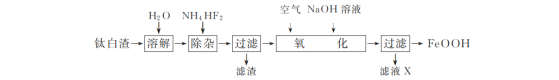
(1)“溶解”时,TiOSO4发生水解生成难溶于水的H2TiO3,反应的化学方程式为________。
(2)“除杂”时,加入NH4HF2固体的作用是________。
(3)“氧化”时,Fe2+生成FeOOH的离子方程式是________。
(4)滤液X中主要含有的阳离子是________(填化学式)。
(5)实验测得反应溶液的pH、温度对氧化铁黄产率的影响如图所示。
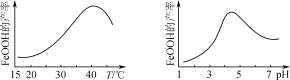
①反应温度宜选择________。
②氧化时应控制pH的合理范围是4.5左右,pH过小或过大均会导致氧化铁黄产率较低,其可能原因是__________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com