
【题目】N2(g)+3H2(g)![]() 2NH3(g)的平衡常数K1的表达式为:_________,
2NH3(g)的平衡常数K1的表达式为:_________,![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g)的平衡常数为K2,2NH3(g)
NH3(g)的平衡常数为K2,2NH3(g)![]() N2(g)+3H2(g)的平衡常数K3。K1与K2的关系式:________,K1与K3的关系式:________。
N2(g)+3H2(g)的平衡常数K3。K1与K2的关系式:________,K1与K3的关系式:________。
 同步练习强化拓展系列答案
同步练习强化拓展系列答案科目:高中化学 来源: 题型:
【题目】常温下,0.2mol/L一元酸HA与等浓度的NaOH溶液等体积混合后,所得溶液中部分微粒组分及浓度如图所示,下列说法正确的是

A. HA是强酸
B. 该混合液pH=7
C. 图中x表示HA,Y表示OH-,Z表示H+
D. 该混合溶液中:c(A-)+c(Y)=c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物如图的分子式均为C7H8。下列说法正确的是
![]()
A. W、M、N均能与溴水发生加成反应B. W、M、N的一氯代物数目相等
C. W、M、N分子中的碳原子均共面D. W、M、N均能使酸性KMnO4溶液褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室进行了如图所示的实验,下列说法中错误的是

A. X、Z烧杯中分散质相同
B. Y中反应离子方程式为3CaCO3+2Fe3++3H2O==2Fe(OH)3(胶体)+3CO2↑+3Ca2
C. 利用过滤的方法,可将Z中固体与液体分离
D. Z中分散系能产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式书写正确的是 ( )
A. 向水中通入氯气:Cl2+H2O![]() 2H++Cl-+ClO-
2H++Cl-+ClO-
B. 向氯化铁溶液中加入铜:2Fe3++3Cu===2Fe+3Cu2+
C. NH4HCO3溶液与过量KOH浓溶液共热:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
D. 向二氧化锰中滴加浓盐酸并加热:MnO2+4H++2Cl-![]() Mn2++Cl2↑+2H2O
Mn2++Cl2↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发射嫦娥三号的长征三号乙运载火箭,其中第3级火箭中的能源物质为液态H2和液态O2,发生的反应为2H2(g)+O2(g)===2H2O(g)。下列说法不正确的是( )

A. 化合反应都是放热反应
B. 2 mol气态H2与1 mol气态O2的总能量大于2 mol水蒸气的总能量
C. 断裂2 mol H—H键、1 mol O—O键吸收的总能量小于形成4 mol H—O键释放的总能量
D. 氢气燃烧过程中能量变化可用如图表示:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2 mol SO2和2 mol SO3气体混合于某固定体积的密闭容器中,在一定条件下反应:2SO2(g)+O2(g)![]() 2SO3(g),平衡时SO3为W mol。相同温度下,分别按下列配比在相同体积的容器中反应,反应达到平衡时,SO3的物质的量大于W mol的是( )
2SO3(g),平衡时SO3为W mol。相同温度下,分别按下列配比在相同体积的容器中反应,反应达到平衡时,SO3的物质的量大于W mol的是( )
A.2 mol SO2+1 mol O2B.4 mol SO2+1 mol O2
C.2 mol SO2+1 mol O2+2 mol SO3D.3 mol SO2+1 mol SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】参考下列图表和有关要求回答问题:
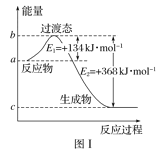
(1)图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是___(填“增大”“减小”或“不变”,下同),ΔH的变化是__。请写出NO2和CO反应的热化学方程式:__。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
又知③H2O(g)=H2O(l) ΔH=-44kJ·mol-1
则甲醇燃烧生成液态水的热化学方程式:___。
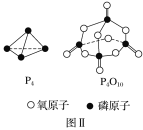
(3)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/kJ·mol-1 | a | b | c | x |
已知1mol白磷(P4)完全燃烧放热为dkJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=___kJ·mol-1(用含有a、b、c、d的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用CO和水蒸气在一定条件下发生反应制取氢气:
CO(g)+H2O(g)![]() CO2(g)+H2(g) △H=-41 kJ/mol
CO2(g)+H2(g) △H=-41 kJ/mol
某小组研究在相同温度下该反应过程中的能量变化。他们分别在体积均为VL的两个恒温恒容密闭容器中加入一定量的反应物,使其在相同温度下发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达到平衡的时间/min | 达平衡时体系能量的变化/kJ | |||
CO | H2O | CO2 | H2 | |||
① | 1 | 4 | 0 | 0 | t1 | 放出热量:32.8 kJ |
② | 2 | 8 | 0 | 0 | t2 | 放出热量:Q |
(1)该反应过程中,反应物分子化学键断裂时所吸收的总能量_____________(填“大于”、“小于”或“等于”)生成物分子化学键形成时所释放的总能量。
(2)容器①中反应达平衡时,CO的转化率为_____________。
(3)计算容器①中反应的平衡常数K=_____________。某时刻测得②中氢气的物质的量为1.8mol,请问此刻V正 V逆(填大于,小于或等于)
(4)下列叙述正确的是_____________(填字母序号)。
a.平衡时,两容器中H2的体积分数相等
b.容器②中反应达平衡状态时,Q > 65.6 kJ
c.反应开始时,两容器中反应的化学反应速率相等
d.平衡时,两容器中CO的转化率相同
(5)已知:2H2(g)+O2(g)=2H2O(g)ΔH=-484kJ/mol,请写出CO完全燃烧生成CO2的热化学方程式: 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com