
【题目】参考下列图表和有关要求回答问题:
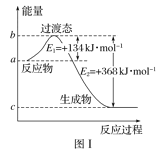
(1)图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是___(填“增大”“减小”或“不变”,下同),ΔH的变化是__。请写出NO2和CO反应的热化学方程式:__。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
又知③H2O(g)=H2O(l) ΔH=-44kJ·mol-1
则甲醇燃烧生成液态水的热化学方程式:___。
(3)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/kJ·mol-1 | a | b | c | x |
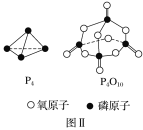
已知1mol白磷(P4)完全燃烧放热为dkJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=___kJ·mol-1(用含有a、b、c、d的代数式表示)。
【答案】减小 不变 NO2(g)+CO(g)=CO2(g)+NO(g) ΔH=-234kJ·mol-1 CH3OH(g)+![]() O2(g)=CO2(g)+2H2O(l) ΔH=-764.7kJ·mol-1
O2(g)=CO2(g)+2H2O(l) ΔH=-764.7kJ·mol-1 ![]()
【解析】
加入催化剂能降低反应所需的活化能,但是不改变反应物的总能量和生成物的总能量,由图可知,1molNO2和1molCO反应生成CO2和NO放出热量368-134=234kJ,根据热化学方程式书写原则进行书写;
依据热化学方程式,利用盖斯定律即化学反应的反应热只与反应体系的始态和终态有关,而与反应的途径无关,进行计算;
白磷燃烧的方程式为![]() ,结合1mol白磷中含有6molP-P,1molO2中含有1molO-O,1molP4O10中含有12mol P-O、4mol P=O分析;
,结合1mol白磷中含有6molP-P,1molO2中含有1molO-O,1molP4O10中含有12mol P-O、4mol P=O分析;
化学反应中旧键断裂需要吸收能量,新键形成需要放出能量,结合化学反应中的反应热△H=反应物总键能-生成物总键能分析。
(1)加入催化剂能降低反应所需的活化能,则E1和E2都减小,催化剂不能改变反应物的总能量和生成物的总能量之差,即反应热不改变,所以催化剂对反应热无影响,由图可知,1molNO2和1molCO反应生成CO2和NO放出热量368-134=234kJ,反应热化学方程式为![]() ;故答案为:减小;不变;
;故答案为:减小;不变;
![]() ;
;
(2)![]() ①
①
![]() ②
②
![]() ③
③
依据盖斯定律,②×3-①×2+③×2得:![]()
![]() (3)加入催化剂能降低反应所需的活化能,则E1和E2都减小,催化剂不能改变反应物的总能量和生成物的总能量之差,即反应热不改变,所以催化剂对反应热无影响,所以
(3)加入催化剂能降低反应所需的活化能,则E1和E2都减小,催化剂不能改变反应物的总能量和生成物的总能量之差,即反应热不改变,所以催化剂对反应热无影响,所以![]() ,解得
,解得![]() 。
。
故答案为![]() 。
。


 通城学典默写能手系列答案
通城学典默写能手系列答案 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】(1)依据反应:2Ag+(aq)+Cu(s)![]() Cu2+(aq)+2Ag(s)设计的原电池如下图甲所示。
Cu2+(aq)+2Ag(s)设计的原电池如下图甲所示。
①电极X的材料是___________;Y溶液可以是____________;
②银电极上发生的电极反应式是_________________________。
③在电池放电过程中,盛有饱和KCl琼脂溶胶的盐桥中,向CuSO4溶液一端扩散的离子是______(填离子符号)。
(2)金属腐蚀一般可分为化学腐蚀和电化学腐蚀,可以采用电化学手段进行防腐。
①炒菜的铁锅未及时清洗容易生锈。写出铁锅生锈过程的正极反应式__________________。
②为了减缓某水库铁闸门被腐蚀的速率,可以采用下图乙所示的方案,其中焊接在铁闸门上的固体材料R可以采用___________(填写字母序号)。
A.铜 B.钠 C.锌 D.石墨
③图丙所示方案也可以减缓铁闸门的腐蚀速率,则铁闸门应连接直流电源的_______极。

(3)蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应是:NiO2 + Fe + 2H2O![]() Fe(OH)2 + Ni(OH)2。
Fe(OH)2 + Ni(OH)2。
①若此蓄电池放电时,该电池某一电极发生还原反应的物质是____(填序号)。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
②该电池放电时,正极附近溶液的PH_________(填增大、减小、不变)
③充电时该电池阳极的电极反应式________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N2(g)+3H2(g)![]() 2NH3(g)的平衡常数K1的表达式为:_________,
2NH3(g)的平衡常数K1的表达式为:_________,![]() N2(g)+
N2(g)+![]() H2(g)
H2(g)![]() NH3(g)的平衡常数为K2,2NH3(g)
NH3(g)的平衡常数为K2,2NH3(g)![]() N2(g)+3H2(g)的平衡常数K3。K1与K2的关系式:________,K1与K3的关系式:________。
N2(g)+3H2(g)的平衡常数K3。K1与K2的关系式:________,K1与K3的关系式:________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】8.34 g FeSO4·7H2O(相对分子质量:278)样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示,下列说法正确的是
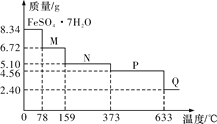
A. 温度为78 ℃时固体物质M的化学式为FeSO4·5H2O
B. 取适量380 ℃时所得的样品P,隔绝空气加热至650 ℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe3O4
C. 在隔绝空气条件下,N得到P的化学方程式为FeSO4·H2O![]() FeSO4+H2O
FeSO4+H2O
D. 温度为159 ℃时固体N的化学式为FeSO4·2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钛铁矿主要成分为FeTiO3(含有少量MgO、SiO2等杂质),Li4Ti5O12和LiFePO4都是锂离子电池的电极材料,可利用钛铁矿来制备,工艺流程如下:

(1)钛铁矿在预处理时需要进行粉碎,其原因是___________________。
(2)过程①中反应的离子方程式是: FeTiO3 + 4H++ 4Cl-== Fe2+ + TiOCl42-+ 2H2O、_______。
(3)过程①中,铁的浸出率结果如图1所示。由图可知,当铁的浸出率为80%时,所采用的实验条件是___________________。

(4)过程②中固体TiO2与双氧水、氨水反应转化成(NH4)2Ti5O15溶液时,Ti元素的浸出率与反应温度的关系如图2所示,反应温度过高时,Ti元素浸出率下降的原因是___________。
(5)在滤液B转化为FePO4沉淀过程中发生以下反应,请配平:
Fe2+ +_____ + H3PO4 ===FePO4 + ____ + _____
(6)过程③中由FePO4制备LiFePO4的化学方程式是_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对下列各种溶液中所含离子的判断合理的是( )
A.向无色溶液中加氯水变橙色,溶液中可能含:SO42-、Br-、OH-、Ba2+
B.25℃时在水电离出的c(H+)=1.0×10-11mol/L的溶液中可能含:Mg2+、Cu2+、SO42-、NO3-
C.25℃时![]() =0.1 mol/L的溶液中可能含:Na+、K+、CO32-、NO3-
=0.1 mol/L的溶液中可能含:Na+、K+、CO32-、NO3-
D.在c(Fe3+)=1.0mol/L的溶液中可能含:K+、Na+、SCN-、HCO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某澄清透明溶液中只可能含有①![]() ,②
,②![]() ,③
,③![]() ,④
,④![]() ,⑤
,⑤![]() ,⑥
,⑥![]() ,⑦
,⑦![]() 中的几种,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示.则该溶液中一定含有的离子是
中的几种,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示.则该溶液中一定含有的离子是
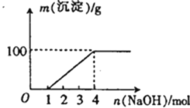
A.②⑤⑥⑦B.②③⑤⑦C.①②③⑥⑦D.①②③④⑤⑦
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国古代科技十分发达,下列对古文献的解释不正确的是
序号 | 古文 | 解释 |
A | 烧酒非古法也,自元时创始,其法用浓酒和糟入甑 | 白酒 |
B | 白青 | 可以用铁来冶炼铜 |
C | 初,人不知盖泥法,元时南安有黄长者为宅煮糖,宅垣忽坏,去土而糖白,后人遂效之 | 蔗糖的分离提纯采用了黄泥来吸附红糖中的色素 |
D | 丹砂烧之成水银,积变又成丹砂 | 加热时丹砂 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图,C、D,E、F、X、Y都是惰性电极。将电源接通后,向(乙)中滴入酚酞溶液,在F极附近显红色。则下列说法正确的是( )
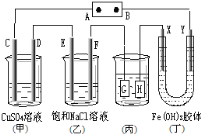
A.若用乙烷、空气燃料电池作电源,电解质为KOH溶液,则B极的电极反应式为:O2+2H2O+4e-=4OH-
B.欲用(丙)装置给铜镀银,H应该是Ag,电镀液是AgNO3溶液
C.(丁)装置中Y极附近红褐色变深,说明氢氧化铁胶粒带负电荷
D.C、D、E、F电极均有单质生成,其物质的量比为1:2:2:2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com