
【题目】8.34 g FeSO4·7H2O(相对分子质量:278)样品受热脱水过程的热重曲线(样品质量随温度变化的曲线)如下图所示,下列说法正确的是
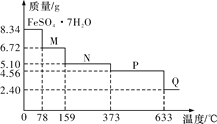
A. 温度为78 ℃时固体物质M的化学式为FeSO4·5H2O
B. 取适量380 ℃时所得的样品P,隔绝空气加热至650 ℃,得到一种固体物质Q,同时有两种无色气体生成,Q的化学式为Fe3O4
C. 在隔绝空气条件下,N得到P的化学方程式为FeSO4·H2O![]() FeSO4+H2O
FeSO4+H2O
D. 温度为159 ℃时固体N的化学式为FeSO4·2H2O
【答案】C
【解析】
8.34 g FeSO4·7H2O 样品的物质的量为8.34 g÷278 g/mol=0.03 mol,其中m(H2O)=0.03 mol×7×18 g/mol=3.78 g,如晶体失去全部结晶水,固体的质量应为8.34 g-3.78 g=4.56 g,可知在加热到373℃之前,晶体失去部分结晶水,据此回答。
A.温度为78 ℃时,固体质量为6.72 g,其中m(FeSO4)=0.03 mol×152 g/mol=4.56 g,m(H2O)=6.72 g-4.56 g=2.16 g,n(H2O)=2.16 g÷18 g/mol=0.12 mol,则n(H2O)∶n(FeSO4)=0.12 mol∶0.03 mol=4∶1,则化学式为FeSO4·4H2O,A项错误;
B.加热至650 ℃时,固体的质量为2.40 g,其中n(Fe)=n(FeSO4·7H2O)=0.03 mol,m(Fe)=0.03 mol×56 g/mol=1.68 g,则固体中m(O)=2.40 g-1.68 g=0.72 g,n(O)=0.72 g÷16 g/mol=0.045 mol,则n(Fe)∶n(O)=0.03 mol∶0.045 mol=2∶3,则固体物质Q的化学式为Fe2O3,B项错误;
C.固体N的质量为5.10 g,其中m(FeSO4)=0.03 mol×152 g/mol=4.56 g,m(H2O)=5.10 g-4.56 g=0.54 g,n(H2O)=0.54 g÷18 g/mol=0.03 mol,则n(H2O)∶n(FeSO4)=0.03 mol∶0.03 mol=1∶1,则N的化学式为FeSO4·H2O,P的化学式为FeSO4,则在隔绝空气条件下由N得到P的化学方程式为FeSO4·H2O![]() FeSO4+H2O,C项正确;
FeSO4+H2O,C项正确;
D.温度为159℃时,由C项可知N的化学式为FeSO4·H2O,D项错误。
故选C。


 通城学典默写能手系列答案
通城学典默写能手系列答案科目:高中化学 来源: 题型:
【题目】以菱锰矿![]() 主要成分
主要成分![]() ,还含有
,还含有![]() 、
、![]() 等杂质
等杂质![]() 为原料制备二氧化锰的工艺流程如下:
为原料制备二氧化锰的工艺流程如下:
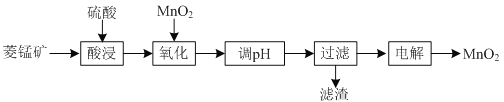
已知部分金属离子开始沉淀及沉淀完全时的pH如下表所示:
金属离子 |
|
|
|
|
开始沉淀时的pH |
|
|
|
|
沉淀完全时的pH |
|
|
|
|
(1)①“酸浸”时![]() 发生反应的离子方程式为________________________________________。
发生反应的离子方程式为________________________________________。
②“酸浸”过程中加入过量硫酸的目的除了加快酸浸的速率、_____________、___________。
③要提高“酸浸”的速率,还可以采取的方法是________________________________________。
(2)“氧化”时发生反应的离子方程式为________________________________________。
(3)“调pH”的目的是除去溶液中的杂质金属离子,“调pH”的范围应为_______________。
(4)当溶液中c(Al3+)≤10-5mol/L时,则认为![]() 沉淀完全,则
沉淀完全,则![]() ______________。
______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室进行了如图所示的实验,下列说法中错误的是

A. X、Z烧杯中分散质相同
B. Y中反应离子方程式为3CaCO3+2Fe3++3H2O==2Fe(OH)3(胶体)+3CO2↑+3Ca2
C. 利用过滤的方法,可将Z中固体与液体分离
D. Z中分散系能产生丁达尔效应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】发射嫦娥三号的长征三号乙运载火箭,其中第3级火箭中的能源物质为液态H2和液态O2,发生的反应为2H2(g)+O2(g)===2H2O(g)。下列说法不正确的是( )

A. 化合反应都是放热反应
B. 2 mol气态H2与1 mol气态O2的总能量大于2 mol水蒸气的总能量
C. 断裂2 mol H—H键、1 mol O—O键吸收的总能量小于形成4 mol H—O键释放的总能量
D. 氢气燃烧过程中能量变化可用如图表示:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将2 mol SO2和2 mol SO3气体混合于某固定体积的密闭容器中,在一定条件下反应:2SO2(g)+O2(g)![]() 2SO3(g),平衡时SO3为W mol。相同温度下,分别按下列配比在相同体积的容器中反应,反应达到平衡时,SO3的物质的量大于W mol的是( )
2SO3(g),平衡时SO3为W mol。相同温度下,分别按下列配比在相同体积的容器中反应,反应达到平衡时,SO3的物质的量大于W mol的是( )
A.2 mol SO2+1 mol O2B.4 mol SO2+1 mol O2
C.2 mol SO2+1 mol O2+2 mol SO3D.3 mol SO2+1 mol SO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NiSO4是制备磁性材料和催化剂的重要中间体。用含镍废料(主要成分为NiO,含有少量CuO、FeO和SiO2)制备NiSO4并回收金属资源的流程如图:
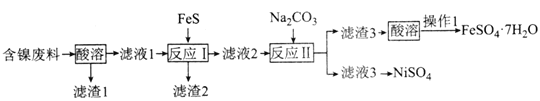
下列说法错误的是( )
A.“酸溶”时应选用硫酸
B.滤渣2的成分为CuS和FeS
C.“操作1”为蒸发结晶
D.合理处理废弃物有利于保护环境和资源再利用
查看答案和解析>>
科目:高中化学 来源: 题型:
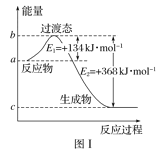
【题目】参考下列图表和有关要求回答问题:
(1)图Ⅰ是1molNO2(g)和1molCO(g)反应生成CO2和NO过程中能量变化示意图,若在反应体系中加入催化剂,反应速率增大,E1的变化是___(填“增大”“减小”或“不变”,下同),ΔH的变化是__。请写出NO2和CO反应的热化学方程式:__。
(2)甲醇质子交换膜燃料电池中将甲醇蒸气转化为氢气的两种反应原理是:
①CH3OH(g)+H2O(g)=CO2(g)+3H2(g) ΔH=+49.0kJ·mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
O2(g)=CO2(g)+2H2(g) ΔH=-192.9kJ·mol-1
又知③H2O(g)=H2O(l) ΔH=-44kJ·mol-1
则甲醇燃烧生成液态水的热化学方程式:___。
(3)下表是部分化学键的键能数据:
化学键 | P—P | P—O | O=O | P=O |
键能/kJ·mol-1 | a | b | c | x |
已知1mol白磷(P4)完全燃烧放热为dkJ,白磷及其完全燃烧的产物结构如图Ⅱ所示,则表中x=___kJ·mol-1(用含有a、b、c、d的代数式表示)。
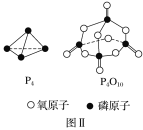
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】卤块的主要成分是MgCl2,此外还含Fe3+、Fe2+和Mn2+等离子。若以它为原料按下图所示工艺流程进行生产,可制得轻质氧化镁。
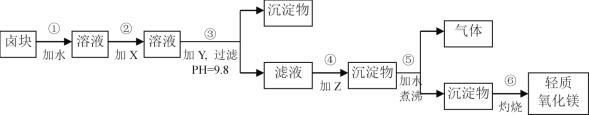
表1
物质 | 开始沉淀 | 沉淀完全 |
Fe(OH)3 | 2.7 | 3.7 |
Fe(OH)2 | 7.6 | 9.6 |
Mn(OH)2 | 8.3 | 9.8 |
Mg(OH)2 | 9.6 | 11.1 |
﹡Fe2+氢氧化物呈絮状,不易从溶液中除去,必须将它氧化后以Fe(OH)3沉淀形式才能除尽
表2
物质 | 价格(元/吨) |
漂白液(含25.2%NaClO) | 450 |
双氧水(含30%H2O2) | 2400 |
烧碱(含98%NaOH) | 2100 |
纯碱(含99.5%Na2CO3) | 600 |
若要求产品尽量不含杂质,而且生产成本较低,根据表1和表2提供的资料,回答下列问题:
(1)步骤②中加入的试剂X,最佳选择_____________(填物质名称),其作用是___________________。
(2)步骤③生成的沉淀物含有____________________(填化学式)。
(3)步骤⑤中发生反应的化学方程式为_____________________________。
(4)若在实验室进行步骤⑥的灼烧实验,必须用到的仪器是铁三脚、酒精喷灯、________和泥三角。
(5)在实验室中,为了除去MgCl2酸性溶液中的Fe3+而得到较纯净的MgCl2溶液,可在加热搅拌的条件下加入一种试剂,过滤后,再向滤液中加入适量的盐酸,这种试剂是____________(填字母)。
A.NH3·H2O B.NaOH C.Na2CO3 D.MgCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、N、X、Y、Z是原子序数依次增大的短周期主族元素。Y所处的周期序数与族序数相等。甲、乙、丙、丁、戊是由这些元素组成的化合物,丁是氯碱工业的-种产物,戊为二元化合物,常温下0.01 mol·L— 1戊溶液的pH为2。上述物质的转化关系如图所示。下列说法中错误的是

A.原子半径: N<Y<XB.W2N分子的比例模型为![]()
C.物质丁中含有离子键和共价键D.丙在固态时属于分子晶体
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com