
【题目】(1)基态碳原子的核外电子排布式为______。
(2)基态铬原子外围电子轨道表示式为___。
(3)卤族元素F、Cl的电负性由小到大的顺序是______。
(4)比较晶格能:MgO___MgS(用“>”、“<”)
(5)CO分子内σ键与π键个数之比为________。
(6)比较第一电离能:Mg___Al(用“>”、“<”)
(7)乙炔是________(填“非极性”或“极性”)分子。
(8)丙烯(CH3CH=CH2)分子中碳原子的杂化方式为________和________。
(9)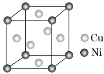 某镍白铜合金的立方晶胞结构如图所示。晶胞中铜原子与镍原子的数量比为________。
某镍白铜合金的立方晶胞结构如图所示。晶胞中铜原子与镍原子的数量比为________。
【答案】1s22s22p2 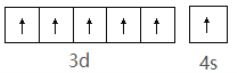 Cl <F > 1:2 > 非极性 sp3 sp2 3:1
Cl <F > 1:2 > 非极性 sp3 sp2 3:1
【解析】
(1)C位于周期表的第二周期ⅣA,属于p区元素,其基态原子电子排布式为1s22s22p2;
(2)基态铬原子的外围电子排布式为3d54s1,相应的电子轨道表示式即电子排布图为![]() ;
;
(3)周期表中同一主族的元素,从上至下,元素的电负性逐渐减小,因此电负性Cl<F;
(4)由于S2-的半径大于O2-,所以Mg2+和S2-的离子键较弱,所以MgS的晶格能较小;
(5)CO分子内C和O原子之间形成的是三键,三键中包含1个σ键和2个π键,因此比例是1:2;
(6)同周期元素,第一电离能从左至右呈现增大趋势;由于Mg的3s轨道处于全充满的状态,能量更低更稳定,因此其第一电离能大于Al的;;
(7)乙炔分子是直线型分子,分子中的正电荷中心和负电荷中心重叠,因此属于非极性分子;
(8)丙烯分子中甲基中的C原子采用sp3的杂化方式,形成碳碳双键的C原子采用sp2的杂化方式;
(9)由晶胞结构可知,Cu原子位于晶胞的面心处,因此一个晶胞中Cu原子的个数为![]() 个;Ni原子位于晶胞的顶点上,因此一个晶胞中Ni原子的个数为
个;Ni原子位于晶胞的顶点上,因此一个晶胞中Ni原子的个数为![]() 个;因此晶胞中Cu原子和Ni原子的个数比为3:1。
个;因此晶胞中Cu原子和Ni原子的个数比为3:1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】连二亚硫酸钠(Na2S2O4)是印染工业的一种常用原料,连二亚硫酸钠又称保险粉,可溶于水,但不溶于甲醇,其固体受热、遇水都会发生反应放出大量的热,甚至引起燃烧,工业制备流程如图:
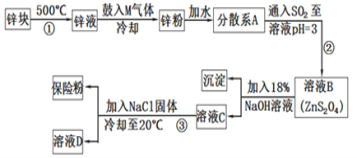
请回答下列问题:
(1)保存连二亚硫酸钠的注意事项___(任写一项)。
(2)鼓入的气体M为空气的一种主要成分,则M的电子式为___;
(3)流程②的化学方程式为__。
(4)流程③的分离方法步骤为过滤、洗涤、干燥。其中洗涤所用试剂是___;实验时加入NaCl固体的作用是__。
(5)连二亚硫酸钠可以用于除去废水中的重铬酸根离子(Cr2O72-被转化为Cr3+,S2O42-被转化为SO42-),写出该反应的离子方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家用蘸墨汁书写后的纸张作为空气电极,设计并组装了轻型、柔性、能折叠的可充电锂空气电池如下图1所示,电池的工作原理如下图2所示。下列有关说法正确的是

A. 放电时,纸张中的纤维素作锂电池的正极
B. 闭合开关K给锂电池充电,X为直流电源正极
C. 放电时,Li+由正极经过有机电解质溶液移向负极
D. 充电时,阳极的电极反应式为Li2O2-2e-=O2 +2Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究碳酸氢钠的热稳定性,并利用其产物验证过氧化钠与二氧化碳的反应,按以下装置图进行实验,按要求填空。

(1)A中反应的化学方程式为________。
(2)B中浓硫酸的作用是____。
(3)C中发生反应的化学方程式为____,每反应1molNa2O2转移______mol电子。
(4)D中现象是_____,反应的离子方程式是_____________________。
(5)E中收集的气体主要是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有以下的物质相互转化关系,A是常见的金属单质,能被磁铁吸引.
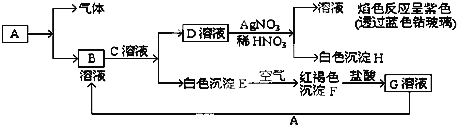
(1)试回答:写出B的化学式__________C的化学式__________H的化学式__________
(2)写出由E转变成F的化学方程式__________.
(3)向G溶液加入A的有关离子反应方程式__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列9种微粒:![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 。按要求完成以下各题:
。按要求完成以下各题:
(1)![]() 、
、![]() 分别是氢元素的一种______,它们互为______。
分别是氢元素的一种______,它们互为______。
(2)互为同素异形体的微粒是______。
(3)![]() 的中子数为______,核外电子数为______。
的中子数为______,核外电子数为______。
(4)形成上述9种微粒的核素有______种、元素有______种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是目前人类使用量最大的金属,它能形成多种化合物。
(1)取5.6g生铁与足量的稀硫酸混合反应,无论怎样进行实验,最终收集的气体体积均小于2.24L(标准状况),最主要的原因是___;所得溶液在长时间放置过程中会慢慢出现浅黄色,试用离子方程式解释这一变化的原因:___。
(2)ZnFe2O4是一种新型纳米材料,可将工业废气中的CO转化为CO2,则ZnFe2O4中Fe元素的化合价为___。ZnFe2O4和CO在1200℃发生反应:6ZnFe2O4+2CO![]() 6ZnO+2CO2+aM(其中a为化合物M的化学计量数),则M的化学式为___,反应中ZnFe2O4作___剂。
6ZnO+2CO2+aM(其中a为化合物M的化学计量数),则M的化学式为___,反应中ZnFe2O4作___剂。
(3)LiFePO4是锂离子电池材料之一。以FePO4、Li2CO3和单质碳为原料在高温下制备LiFePO4,该反应还生成一种可然性气体,则反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
![]() 工业利用冶铜炉渣
工业利用冶铜炉渣![]() 含Fe2O3、FeO、SiO2、Al2O3等
含Fe2O3、FeO、SiO2、Al2O3等![]() 制Fe2O3的生产流程示意图如下:
制Fe2O3的生产流程示意图如下:
炉渣![]() 滤液
滤液![]() 沉淀
沉淀![]() 氧化铁
氧化铁
经“足量的NaOH溶液”处理后,铝元素的存在形态为 ______ ![]() 填序号
填序号![]() .
.
a.Al b.Al(OH)3 c.Al3+ d.AlO2-
![]() 要证明某溶液不含Fe3+但可能含有Fe2+,最佳的实验操作顺序是 ______
要证明某溶液不含Fe3+但可能含有Fe2+,最佳的实验操作顺序是 ______ ![]() 填序号
填序号![]() .
.
①加入少量氯水②加入足量KMnO4溶液③加入少量NH4SCN溶液
a. ①③ b.③② c. ③① d. ①②③
(3)25℃时,23gC2H5OH在血液中被氧气完全氧化放出668kJ热量,该反应的热化学方程式为 ______ .
(4)X、Y、Z、Q、R是原子序数依次增大的短周期主族元素,X、Q同主族,Z+与Y2-具有相同的电子层结构,Q 的单质是一种重要的半导体材料,R的单质在常温下呈气态.
①X、Y、Z三种元素的原子半径从大到小的顺序是 ______ ![]() 用元素符号表示
用元素符号表示![]() ,写出含有X、Y、Z三种元素且水溶液显碱性的物质化学式 ______ .
,写出含有X、Y、Z三种元素且水溶液显碱性的物质化学式 ______ .
![]() 下列选项一定能说明R的非金属性比X强的是 ______
下列选项一定能说明R的非金属性比X强的是 ______ ![]() 填序号
填序号![]() .
.
a.原子的半径:r(R)>r(X)
b.原子的最外层电子数:n(R)>n(X)
c.热稳定性:R的气态氢化物>X的气态氢化物
d.酸性:R的最高价氧化物对应的水化物>X的最高价氧化物对应的水化物
③R在周期表的位置是 ______ R和Q形成的化合物在潮湿的空气中冒白色烟雾,该反应的化学方程式为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
钛镍形状记忆合金(TiNi)被广泛用于人造卫星和宇宙飞船的天线,在临床医疗领域内也具有广泛的应用。回答下列问题:
(1)写出基态Ti原子的电子排布式:_________,Ni在元素周期表中的位置是_________。
(2)钛镍合金能溶于热的硫酸生成Ti(SO4)2、NiSO4,二者阴离子的立体构型为______,中心原子的轨道杂化类型是_______。
(3)工业上将金红石(主要成分TiO2)转化为液态TiCl4,再用金属镁在高温下还原得到金属钛,同时生成MgCl2。
①MgCl2的熔沸点比TiCl4高得多,其原因是______。
②原子半径r(Cl)_____r(Mg),离子半径r(O2-)______r(Mg2+)(填“>”、“<”或“=”)。
(4)金属镍能与CO反应生成一种配合物Ni(CO)4(常温下为无色液体)。Ni(CO)4的固体属于_____晶体,Ni与CO之间的化学键称为__________,提供孤对电子的成键原子是_________。(填元素符号)
(5)一种钛镍合金的立方晶胞结构如图所示:
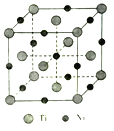
①该合金中Ti的配位数为________。
②若合金的密度为d g/cm3,晶胞边长a=________pm。(用含d的计算式表示)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com