
【题目】已知有以下的物质相互转化关系,A是常见的金属单质,能被磁铁吸引.
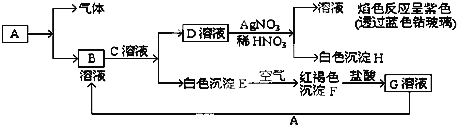
(1)试回答:写出B的化学式__________C的化学式__________H的化学式__________
(2)写出由E转变成F的化学方程式__________.
(3)向G溶液加入A的有关离子反应方程式__________.
【答案】FeCl2 KOH AgCl 4Fe(OH)2+O2+2H2O=4Fe(OH)3 2Fe3++Fe=3Fe2+
【解析】
A是常见的金属单质,能被磁铁吸引,所以A为铁,红色沉淀F为Fe(OH)3,根据题中各物的转化关系可知,E为Fe(OH)2,G为FeCl3,通过D与硝酸银反应产物的性质和现象可知D为KCl,H为AgCl,所以C应为KOH,B为FeCl2,
(1)根据上面的分析可知,B为FeCl2,C为KOH,H为AgCl,
(2)由E转变成F的化学方程式为4Fe(OH)2+O2+2H2O=4Fe(OH)3,
(3)向G溶液加入A的有关离子反应方程式为2Fe3++Fe=3Fe2+,


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】由于碳碳双键(![]() )中的π键不能自由旋转,因此
)中的π键不能自由旋转,因此 ![]() 和
和 是两种不同的化合物,互为顺反异构体。则分子式为C3H4Cl2的化合物的烯类异构体有
是两种不同的化合物,互为顺反异构体。则分子式为C3H4Cl2的化合物的烯类异构体有
A. 5种B. 6种C. 7种D. 8种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)普鲁士蓝的化学式是KFe[Fe(CN)6],该物质的化学键有离子键、共价键和_____。
(2)KOCN是离子晶体;碳原子采取sp杂化,1mol该物质中含有的π键数目为____。
(3)H2O2常温下是液体,沸点较高(150℃),其主要原因是____。
(4)非金属元素![]() 的第一电离能大于
的第一电离能大于![]() 的第一电离能,原因是______。
的第一电离能,原因是______。
(5)V2O5溶于NaOH溶液,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为________。
(6)已知食盐的密度为ρ g·cm-3,其摩尔质量为M g·mol-1,阿伏加德罗常数为NA,则在食盐晶体晶胞参数是_______cm。
(7)1 mol SiO2晶体中含________ mol Si—O键。
(8)1 mol NH4BF4含有________ mol配位键。
(9)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为:_____________。
(10)体心立方结构的金属如:Na、K、Fe的晶胞的空间占有率表达式为________(含π)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知钼(Mo)的晶胞如图所示,钼原子半径为apm,相对原子质量为M,以NA表示阿伏加德罗常数的值。
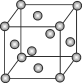
(1)钼晶体的堆积方式为__。
(2)钼原子的配位数为__。
(3)构成钼晶体的粒子是__。
(4)金属钼的密度为__g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把2mol/L CuCl2溶液和2mol/L盐酸等体积混合(假设混合后溶液体积等于混合前两种溶液的体积之和)。请计算:
(1)混合液中CuCl2和盐酸的物质的量浓度;_______________
(2)混合液中H+、Cu2+、Cl-的物质的量浓度;______________
(3)向溶液中加入足量的铁粉,经足够长的时间后,铁粉有剩余。此时溶液中FeCl2的物质的量浓度。____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态碳原子的核外电子排布式为______。
(2)基态铬原子外围电子轨道表示式为___。
(3)卤族元素F、Cl的电负性由小到大的顺序是______。
(4)比较晶格能:MgO___MgS(用“>”、“<”)
(5)CO分子内σ键与π键个数之比为________。
(6)比较第一电离能:Mg___Al(用“>”、“<”)
(7)乙炔是________(填“非极性”或“极性”)分子。
(8)丙烯(CH3CH=CH2)分子中碳原子的杂化方式为________和________。
(9)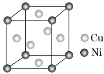 某镍白铜合金的立方晶胞结构如图所示。晶胞中铜原子与镍原子的数量比为________。
某镍白铜合金的立方晶胞结构如图所示。晶胞中铜原子与镍原子的数量比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源等(如图所示),

下列有关说法正确的是
A.第①步中除去粗盐中的![]() 、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为: Na2CO3溶液→BaCl2溶液→NaOH溶液→过滤→适量盐酸调pH
、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为: Na2CO3溶液→BaCl2溶液→NaOH溶液→过滤→适量盐酸调pH
B.MgSO4·7H2O在空气中加热可制得无水MgSO4的方法与第②步相似。
C.从第③步到第⑤步的目的是为了浓缩富集Br2
D.在第③④⑤步中溴元素均被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L密闭容器中充入4 mol A气体和3 mol B气体,发生下列反应:2A(g)+B(g)![]() C(g)+xD(g),5 s达到平衡。达到平衡时,生成了1 mol C,测定D的浓度为1 mol·L-1。
C(g)+xD(g),5 s达到平衡。达到平衡时,生成了1 mol C,测定D的浓度为1 mol·L-1。
(1)求x=_____。
(2)求这段时间A的平均反应速率为_____。
(3)平衡时A的转化率为_____。
(4)下列叙述能说明上述反应达到平衡状态的是_____
A. 单位时间内每消耗2 mol A,同时生成1 mol C
B. 单位时间内每生成1 molB,同时生成1 molC
C. D的体积分数不再变化
D. 混合气体的压强不再变化
E. B、C 的浓度之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是重要的基础有机化工原料。工业中以乙苯(C6H5—CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5—CH=CH2),反应的化学方程式为C6H5—CH2CH3(g)![]() C6H5—CH=CH2(g)+H2(g) ΔH=a kJ·mol-1。
C6H5—CH=CH2(g)+H2(g) ΔH=a kJ·mol-1。
(1)乙苯在特定催化剂下发生氧化脱氢:C6H5—CH2CH3(g)+1/2O2(g)![]() C6H5—CH=CH2(g)+H2O(g) ΔH1
C6H5—CH=CH2(g)+H2O(g) ΔH1
已知H2的燃烧热ΔH=b kJ·mol-1,水的汽化热为c J·g-1,则ΔH1=________。
(2)①在汽车上安装三元催化转化器可实现反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH<0。则该反应在________(填“高温”“低温”或“任何温度”)下能自发进行。
N2(g)+2CO2(g) ΔH<0。则该反应在________(填“高温”“低温”或“任何温度”)下能自发进行。
②在某温度下,2 L密闭容器中充入NO、CO各0.4 mol进行反应,测得NO物质的量变化如图所示,5 min末反应达到平衡。第6 min继续加入0.2 mol NO、0.2 mol CO、0.2 mol CO2和0.3 mol N2,请在图中画出到9 min末反应达到平衡NO的物质的量随时间的变化曲线_______________。

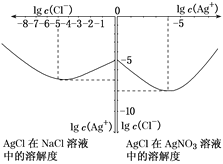
(3)沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。已知AgCl+Cl-=[AgCl2]-,下图是某温度下AgCl在NaCl溶液中的溶解情况。
①由图知,该温度下AgCl的溶度积常数为________。
②AgCl在NaCl溶液中的溶解度出现如图所示情况(先变小后变大)的原因是:______________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com