
【题目】已知钼(Mo)的晶胞如图所示,钼原子半径为apm,相对原子质量为M,以NA表示阿伏加德罗常数的值。
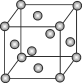
(1)钼晶体的堆积方式为__。
(2)钼原子的配位数为__。
(3)构成钼晶体的粒子是__。
(4)金属钼的密度为__g·cm-3。
【答案】面心立方最密堆积 12 金属离子、自由电子 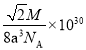
【解析】
(1)由晶胞结构可知,钼晶体的堆积方式为面心立方最密堆积,答案为:面心立方最密堆积;
(2)由晶胞结构可知,一个钼原子的周围有12个钼原子,则钼原子的配位数为12,答案为:12;
(3)金属晶体的成键粒子为金属离子和自由电子,故构成钼晶体的粒子是金属离子和自由电子,答案为:金属离子、自由电子;
(4)由晶胞结构可知,8个钼原子位于顶点,6个钼原子位于面上,利用均摊法,每个晶胞中钼原子的个数为![]() ,则1mol 晶胞质量为:
,则1mol 晶胞质量为:![]() 。钼原子间紧密接触,则可知晶胞中正方形的对角线为4apm,则正方形的边长为
。钼原子间紧密接触,则可知晶胞中正方形的对角线为4apm,则正方形的边长为![]() ,即晶胞的边长为
,即晶胞的边长为![]() ,故
,故![]() ,根据
,根据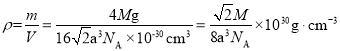 。答案为:
。答案为: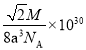 。
。


科目:高中化学 来源: 题型:
【题目】氨硼烷(NH3·BH3)电池可在常温下工作,装置如图所示。未加入氨硼烷之前,两极室质量相等,电池反应为NH3·BH3+3H2O2==NH4BO2+4H2O 。已知H2O2足量,下列说法正确的是( )

A. 正极的电极反应式为2H++2e-===H2↑
B. 电池工作时,H+通过质子交换膜向负极移动
C. 电池工作时,正、负极分别放出H2和NH3
D. 工作足够长时间后,若左右两极室质量差为1.9 g,则电路中转移0.6 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F用于制造香精,可利用下列路线合成。回答下列问题:
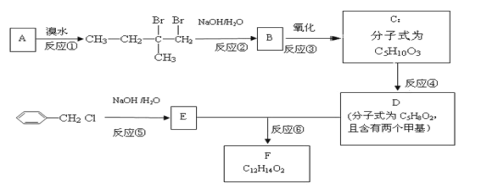
(1)A的化学名称是___。
(2)B的结构简式是___。
(3)①~⑥中属于取代反应的有___(填序号)。
(4)反应⑥的化学方程式为___。
(5)C有多种同分异构体,与C具有相同官能团的有__种(不包括C),其中核磁共振氢谱为四组峰的结构简式为___(任写一种)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家用蘸墨汁书写后的纸张作为空气电极,设计并组装了轻型、柔性、能折叠的可充电锂空气电池如下图1所示,电池的工作原理如下图2所示。下列有关说法正确的是

A. 放电时,纸张中的纤维素作锂电池的正极
B. 闭合开关K给锂电池充电,X为直流电源正极
C. 放电时,Li+由正极经过有机电解质溶液移向负极
D. 充电时,阳极的电极反应式为Li2O2-2e-=O2 +2Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)氯化铁溶液用于检验食用香精乙酰乙酯时,会生成紫色配合物,其配离子结构如图所示。
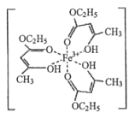
①此配合物中,基态铁离子的价电子排布式为________________。
②此配合物中碳原子的杂化轨道类型有________________。
③此配离子中含有的化学键有____________(填字母)。
A. 离子键 B. 金属键 C. 极性键 D. 非极性键 E. 配位键 F. 氢键 G.σ键 H. π键
④氯化铁在常温下是固体,熔点为 306℃,沸点为 315℃,在 300℃以上升华,易溶于水,也易溶于乙醚、丙酮等有机溶剂。据此判断氯化铁的晶体类型为_________。
(2)基态 A 原子的价电子排布式为 3s23p5,铜与A 形成化合物的晶胞如图所示(黑球代表铜原子)。
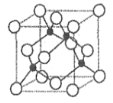
①该化合物的化学式为____________,A原子的配位数是______________。
②已知该化合物晶体的密度为ρg·cm-3,阿伏加德罗常数的值为 NA,则该晶体中 Cu 原子和A 原子之间的最短距离为________pm(列出计算表达式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为探究碳酸氢钠的热稳定性,并利用其产物验证过氧化钠与二氧化碳的反应,按以下装置图进行实验,按要求填空。

(1)A中反应的化学方程式为________。
(2)B中浓硫酸的作用是____。
(3)C中发生反应的化学方程式为____,每反应1molNa2O2转移______mol电子。
(4)D中现象是_____,反应的离子方程式是_____________________。
(5)E中收集的气体主要是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有以下的物质相互转化关系,A是常见的金属单质,能被磁铁吸引.
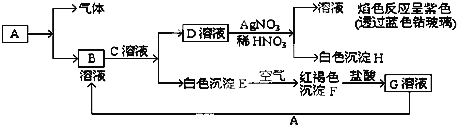
(1)试回答:写出B的化学式__________C的化学式__________H的化学式__________
(2)写出由E转变成F的化学方程式__________.
(3)向G溶液加入A的有关离子反应方程式__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是目前人类使用量最大的金属,它能形成多种化合物。
(1)取5.6g生铁与足量的稀硫酸混合反应,无论怎样进行实验,最终收集的气体体积均小于2.24L(标准状况),最主要的原因是___;所得溶液在长时间放置过程中会慢慢出现浅黄色,试用离子方程式解释这一变化的原因:___。
(2)ZnFe2O4是一种新型纳米材料,可将工业废气中的CO转化为CO2,则ZnFe2O4中Fe元素的化合价为___。ZnFe2O4和CO在1200℃发生反应:6ZnFe2O4+2CO![]() 6ZnO+2CO2+aM(其中a为化合物M的化学计量数),则M的化学式为___,反应中ZnFe2O4作___剂。
6ZnO+2CO2+aM(其中a为化合物M的化学计量数),则M的化学式为___,反应中ZnFe2O4作___剂。
(3)LiFePO4是锂离子电池材料之一。以FePO4、Li2CO3和单质碳为原料在高温下制备LiFePO4,该反应还生成一种可然性气体,则反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用微生物可将废水中苯酚的化学能直接转化为电能,装置如图所示。电池工作时,下列说法正确的是( )
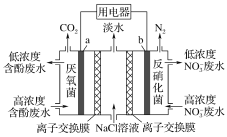
A.a极为正极,发生氧化反应
B.b极的电极反应式为:2NO![]() +12H+-10e-=N2↑+6H2O
+12H+-10e-=N2↑+6H2O
C.中间室的Cl-向左室移动
D.左室消耗苯酚(C6H5OH)9.4 g时,用电器流过2.4 mol电子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com