
【题目】中国科学家用蘸墨汁书写后的纸张作为空气电极,设计并组装了轻型、柔性、能折叠的可充电锂空气电池如下图1所示,电池的工作原理如下图2所示。下列有关说法正确的是

A. 放电时,纸张中的纤维素作锂电池的正极
B. 闭合开关K给锂电池充电,X为直流电源正极
C. 放电时,Li+由正极经过有机电解质溶液移向负极
D. 充电时,阳极的电极反应式为Li2O2-2e-=O2 +2Li+
 活力课时同步练习册系列答案
活力课时同步练习册系列答案 学业测评一课一测系列答案
学业测评一课一测系列答案科目:高中化学 来源: 题型:
【题目】某手机电池采用了石墨烯电池,可充电5分钟,通话2小时。一种石墨烯锂硫电池(2Li+S8 = Li2S8)工作原理示意图如图。

下列有关该电池说法不正确的是( )
A.A 电极为该电源的负极,电极材料主要是金属锂和石墨烯
B.B 电极的反应:2Li++S8+2e = Li2S8
C.充电时,电极A与电源负极连接,作为阴极
D.为提高电池效率,该电池可选用稀硫酸作为电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知有机物A、B、C、D、E、F、G有如图转化关系,其中C的产量可用来衡量一个国家的石油化工发展水平,G的分子式为![]() ,试回答下列有关问题。
,试回答下列有关问题。
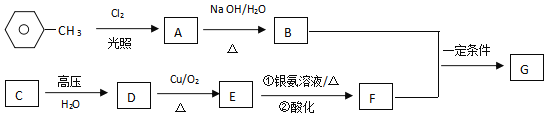
(1)G的结构简式为______。
(2)C转化为D的反应类型:______。
(3)写出B和F反应生成G的化学方程式:______。
(4)写出同时符合下列条件的G的同分异构体结构简式______、______。
①苯环上有3个取代基,且有两个取代基相同;
②能够与新制的银氨溶液反应产生光亮的银镜;
③核磁共振氢谱共有4种吸收峰。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W、Q在元素周期表中的相对位置如图所示。下列说法正确的是
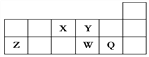
A. 原子半径的大小顺序为:rX>rY>rZ>rW>rQ
B. 元素W的最高价氧化物对应的水化物酸性比Q的强
C. 元素X与元素Z的最高正化合价之和的数值等于8
D. 离子Y2-和Z3+的核外电子数和电子层数都不相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)普鲁士蓝的化学式是KFe[Fe(CN)6],该物质的化学键有离子键、共价键和_____。
(2)KOCN是离子晶体;碳原子采取sp杂化,1mol该物质中含有的π键数目为____。
(3)H2O2常温下是液体,沸点较高(150℃),其主要原因是____。
(4)非金属元素![]() 的第一电离能大于
的第一电离能大于![]() 的第一电离能,原因是______。
的第一电离能,原因是______。
(5)V2O5溶于NaOH溶液,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为________。
(6)已知食盐的密度为ρ g·cm-3,其摩尔质量为M g·mol-1,阿伏加德罗常数为NA,则在食盐晶体晶胞参数是_______cm。
(7)1 mol SiO2晶体中含________ mol Si—O键。
(8)1 mol NH4BF4含有________ mol配位键。
(9)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为:_____________。
(10)体心立方结构的金属如:Na、K、Fe的晶胞的空间占有率表达式为________(含π)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把一定量铁粉放入氯化铁溶液中,完全反应后,所得溶液中 Fe2+和 Fe3+的浓度恰好相等。则已反应的 Fe3+和未反应的 Fe3+的物质的量之比为:
A.4:3B.3:2C.2:3D.1:4
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知钼(Mo)的晶胞如图所示,钼原子半径为apm,相对原子质量为M,以NA表示阿伏加德罗常数的值。
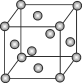
(1)钼晶体的堆积方式为__。
(2)钼原子的配位数为__。
(3)构成钼晶体的粒子是__。
(4)金属钼的密度为__g·cm-3。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态碳原子的核外电子排布式为______。
(2)基态铬原子外围电子轨道表示式为___。
(3)卤族元素F、Cl的电负性由小到大的顺序是______。
(4)比较晶格能:MgO___MgS(用“>”、“<”)
(5)CO分子内σ键与π键个数之比为________。
(6)比较第一电离能:Mg___Al(用“>”、“<”)
(7)乙炔是________(填“非极性”或“极性”)分子。
(8)丙烯(CH3CH=CH2)分子中碳原子的杂化方式为________和________。
(9)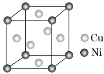 某镍白铜合金的立方晶胞结构如图所示。晶胞中铜原子与镍原子的数量比为________。
某镍白铜合金的立方晶胞结构如图所示。晶胞中铜原子与镍原子的数量比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池应用很广。某种锂离子二次电池的电极材料主要是钴酸锂(LiCoO2)和石墨。钴是一种稀有的贵重金属,废旧锂离子电池电极材料的回收再生意义重大。
(1)锂离子电池(又称锂离子浓差电池)的充电过程:Li+从含LiCoO2的电极中脱出,正三价Co被氧化,此时该极处于贫锂态(Li1-xCoO2)。
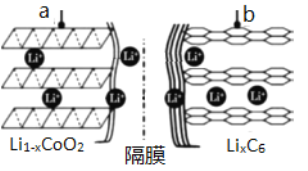
①充电时,a极的电极反应式为____________________________________。
②放电时,电流从______(填“a”或“b”)极流出。
(2)钴酸锂回收再生流程如下:

①H2SO4酸浸时,通常添加30%的H2O2以提高浸出效率,其中H2O2的作用是_______________。
②用盐酸代替H2SO4和H2O2,浸出效率也很高,但工业上不使用盐酸,主要原因之一是:会产生有毒、有污染的气体。写出相应反应的化学方程式______________________________。
③高温下,在O2存在时纯净的CoC2O4与Li2CO3再生为LiCoO2的化学方程式为_______________。
(3)已知下列热化学方程式:
Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1
3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1
写出FeO(s)被CO还原成Fe和CO2的热化学方程式_____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com