
【题目】锂离子电池应用很广。某种锂离子二次电池的电极材料主要是钴酸锂(LiCoO2)和石墨。钴是一种稀有的贵重金属,废旧锂离子电池电极材料的回收再生意义重大。
(1)锂离子电池(又称锂离子浓差电池)的充电过程:Li+从含LiCoO2的电极中脱出,正三价Co被氧化,此时该极处于贫锂态(Li1-xCoO2)。
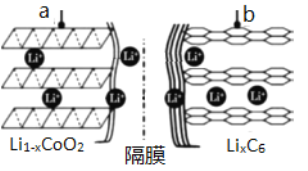
①充电时,a极的电极反应式为____________________________________。
②放电时,电流从______(填“a”或“b”)极流出。
(2)钴酸锂回收再生流程如下:

①H2SO4酸浸时,通常添加30%的H2O2以提高浸出效率,其中H2O2的作用是_______________。
②用盐酸代替H2SO4和H2O2,浸出效率也很高,但工业上不使用盐酸,主要原因之一是:会产生有毒、有污染的气体。写出相应反应的化学方程式______________________________。
③高温下,在O2存在时纯净的CoC2O4与Li2CO3再生为LiCoO2的化学方程式为_______________。
(3)已知下列热化学方程式:
Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1
3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1
写出FeO(s)被CO还原成Fe和CO2的热化学方程式_____________________________。
【答案】LiCoO2-xe-=Li1-xCoO2 +xLi+ a 还原LiCoO2(将LiCoO2中的+3价Co还原为Co2+) 2LiCoO2 +8HCl=2LiCl+2CoCl2 + Cl2↑+4H2O 4CoC2O4+2Li2CO3+3O2![]() 4LiCoO2 +10CO2 FeO(s)+CO(g)===Fe(s)+CO2(g) ΔH=-11 kJ·mol-1或3FeO(s)+3CO(g)===3Fe(s)+3CO2(g) ΔH=-33 kJ·mol-1
4LiCoO2 +10CO2 FeO(s)+CO(g)===Fe(s)+CO2(g) ΔH=-11 kJ·mol-1或3FeO(s)+3CO(g)===3Fe(s)+3CO2(g) ΔH=-33 kJ·mol-1
【解析】
(1) 由题给信息可知充电过程:Li+从含LiCoO2的电极中脱出,正三价Co被氧化,放电时a为正极,发生还原反应生成LiCoO2,b为负极,Li被氧化生成离子;
(2) 由流程可知,钴酸锂滤渣用稀硫酸酸浸,滤液含有钴离子、锂离子,加入草酸,可生成CoC2O4,含锂离子的溶液加入碳酸钠生成碳酸锂,与CoC2O4在高温下反应生成LiCoO2,以此解答该题。
(3) 首先写出FeO(s)被CO还原成Fe和CO2的热化学方程式CO(g)+FeO(s)=Fe(g)+CO2(g)△H,利用盖斯定律①×3-(③×2+②)可得到该化学方程式。
(1) 充电过程:Li+从含LiCoO2的电极中脱出,正三价Co被氧化,放电时a为正极,发生还原反应生成LiCoO2,b为负极,Li被氧化生成离子;
①充电时,a极为阳极,发生氧化反应,则电极反应式为LiCoO2-xe-=Li1-xCoO2 +xLi+;
②放电时,电流从正极流出,即从a极流出。
(2)①添加30% 的H2O2,生成钴离子,可知过氧化氢起到还原剂的作用,还原LiCoO2;
②由题中信息知LiCoO2具有强氧化性,加入盐酸有污染性气体氯气生成,且引入氯离子杂质,在后续步骤中难以分离,反应的方程式为2LiCoO2+8HCl=2LiCl+2CoCl2+Cl2↑+4H2O;
③高温下,在O2存在时纯净的CoC2O4与Li2CO3再生为LiCoO2,同时有CO2生成,发生反应的化学方程式为4CoC2O4+2Li2CO3+3O2![]() 4LiCoO2 +10CO2;
4LiCoO2 +10CO2;
(3) ①Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g);△H=-25kJ/mol,②3Fe2O3(s)+CO(g)=2Fe3O4(s)+CO2(g);△H=-47kJ/mol,③Fe3O4(s)+CO(g)=3FeO(s)+CO2(g);△H=+19kJ/mol,依据盖斯定律①×3-(③×2+②)得到:6CO(g)+6FeO(s)=6Fe(g)+6CO2(g)△H=-66kJ/mol,则FeO(s)被CO还原成Fe和CO2的热化学方程式为FeO(s)+CO(g)===Fe(s)+CO2(g) ΔH=-11 kJ·mol-1或3FeO(s)+3CO(g)===3Fe(s)+3CO2(g) ΔH=-33 kJ·mol-1。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】中国科学家用蘸墨汁书写后的纸张作为空气电极,设计并组装了轻型、柔性、能折叠的可充电锂空气电池如下图1所示,电池的工作原理如下图2所示。下列有关说法正确的是

A. 放电时,纸张中的纤维素作锂电池的正极
B. 闭合开关K给锂电池充电,X为直流电源正极
C. 放电时,Li+由正极经过有机电解质溶液移向负极
D. 充电时,阳极的电极反应式为Li2O2-2e-=O2 +2Li+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是目前人类使用量最大的金属,它能形成多种化合物。
(1)取5.6g生铁与足量的稀硫酸混合反应,无论怎样进行实验,最终收集的气体体积均小于2.24L(标准状况),最主要的原因是___;所得溶液在长时间放置过程中会慢慢出现浅黄色,试用离子方程式解释这一变化的原因:___。
(2)ZnFe2O4是一种新型纳米材料,可将工业废气中的CO转化为CO2,则ZnFe2O4中Fe元素的化合价为___。ZnFe2O4和CO在1200℃发生反应:6ZnFe2O4+2CO![]() 6ZnO+2CO2+aM(其中a为化合物M的化学计量数),则M的化学式为___,反应中ZnFe2O4作___剂。
6ZnO+2CO2+aM(其中a为化合物M的化学计量数),则M的化学式为___,反应中ZnFe2O4作___剂。
(3)LiFePO4是锂离子电池材料之一。以FePO4、Li2CO3和单质碳为原料在高温下制备LiFePO4,该反应还生成一种可然性气体,则反应的化学方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】回答下列问题
![]() 工业利用冶铜炉渣
工业利用冶铜炉渣![]() 含Fe2O3、FeO、SiO2、Al2O3等
含Fe2O3、FeO、SiO2、Al2O3等![]() 制Fe2O3的生产流程示意图如下:
制Fe2O3的生产流程示意图如下:
炉渣![]() 滤液
滤液![]() 沉淀
沉淀![]() 氧化铁
氧化铁
经“足量的NaOH溶液”处理后,铝元素的存在形态为 ______ ![]() 填序号
填序号![]() .
.
a.Al b.Al(OH)3 c.Al3+ d.AlO2-
![]() 要证明某溶液不含Fe3+但可能含有Fe2+,最佳的实验操作顺序是 ______
要证明某溶液不含Fe3+但可能含有Fe2+,最佳的实验操作顺序是 ______ ![]() 填序号
填序号![]() .
.
①加入少量氯水②加入足量KMnO4溶液③加入少量NH4SCN溶液
a. ①③ b.③② c. ③① d. ①②③
(3)25℃时,23gC2H5OH在血液中被氧气完全氧化放出668kJ热量,该反应的热化学方程式为 ______ .
(4)X、Y、Z、Q、R是原子序数依次增大的短周期主族元素,X、Q同主族,Z+与Y2-具有相同的电子层结构,Q 的单质是一种重要的半导体材料,R的单质在常温下呈气态.
①X、Y、Z三种元素的原子半径从大到小的顺序是 ______ ![]() 用元素符号表示
用元素符号表示![]() ,写出含有X、Y、Z三种元素且水溶液显碱性的物质化学式 ______ .
,写出含有X、Y、Z三种元素且水溶液显碱性的物质化学式 ______ .
![]() 下列选项一定能说明R的非金属性比X强的是 ______
下列选项一定能说明R的非金属性比X强的是 ______ ![]() 填序号
填序号![]() .
.
a.原子的半径:r(R)>r(X)
b.原子的最外层电子数:n(R)>n(X)
c.热稳定性:R的气态氢化物>X的气态氢化物
d.酸性:R的最高价氧化物对应的水化物>X的最高价氧化物对应的水化物
③R在周期表的位置是 ______ R和Q形成的化合物在潮湿的空气中冒白色烟雾,该反应的化学方程式为 ______ .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,直到近年来人们才研究出来其成分BaCuSi4O10,BaCuSi2O6。
(1)“中国蓝”、“中国紫”中均具有Cun+离子,n=___。
(2)在5500年前,古代埃及人就己经知道如何合成蓝色颜料—“埃及蓝”CaCuSi4O10,其合成原料中用CaCO3代替了BaCO3,其它和“中国蓝”一致。CO32一中键角∠OCO为___。根据所学,从原料分解的角度判断“埃及蓝”的合成温度比“中国蓝”更___(填“高”或“低”)。
(3)CaCux合金可看作由如图所示的(a)、(b)两种原子层交替堆积排列而成。(a)是由Cu和Ca共同组成的层,层中Cu—Cu之间由实线相连;(b)是完全由Cu原子组成的层,Cu—Cu之间也由实线相连。图中虚线构建的六边形,表示由这两种层平行堆积时垂直于层的相对位置;(c)是由(a)和(b)两种原子层交替堆积成CaCux合金的晶体结构图。在这种结构中,同一层的Ca—Cu距离为294pm,相邻两层的Ca—Cu距离为327pm。
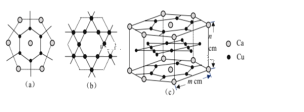
①该晶胞中Ca有___个Cu原子配位(不一定要等距最近)。
②同一层中,Ca原子之间的最短距离是______pm,设NA为阿伏加德罗常数的值,CaCux晶体的密度是_____g/cm3(用含m、n的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是( )
A.少量的碳酸氢钠溶液与澄清石灰水混合:2![]() +2OH-+Ca2+=CaCO3↓+
+2OH-+Ca2+=CaCO3↓+![]() +2H2O
+2H2O
B.过量的碳酸氢钠溶液与澄清石灰水混合:![]() +OH-+Ca2+=CaCO3↓+H2O
+OH-+Ca2+=CaCO3↓+H2O
C.碳酸氢钠溶液与少量的盐酸溶液混合:![]() +H+=CO2↑+H2O
+H+=CO2↑+H2O
D.碳酸钠溶液与过量的盐酸溶液混合:Na2CO3+2H+=2Na++CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用微生物可将废水中苯酚的化学能直接转化为电能,装置如图所示。电池工作时,下列说法正确的是( )
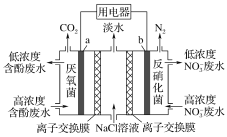
A.a极为正极,发生氧化反应
B.b极的电极反应式为:2NO![]() +12H+-10e-=N2↑+6H2O
+12H+-10e-=N2↑+6H2O
C.中间室的Cl-向左室移动
D.左室消耗苯酚(C6H5OH)9.4 g时,用电器流过2.4 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
钛镍形状记忆合金(TiNi)被广泛用于人造卫星和宇宙飞船的天线,在临床医疗领域内也具有广泛的应用。回答下列问题:
(1)写出基态Ti原子的电子排布式:_________,Ni在元素周期表中的位置是_________。
(2)钛镍合金能溶于热的硫酸生成Ti(SO4)2、NiSO4,二者阴离子的立体构型为______,中心原子的轨道杂化类型是_______。
(3)工业上将金红石(主要成分TiO2)转化为液态TiCl4,再用金属镁在高温下还原得到金属钛,同时生成MgCl2。
①MgCl2的熔沸点比TiCl4高得多,其原因是______。
②原子半径r(Cl)_____r(Mg),离子半径r(O2-)______r(Mg2+)(填“>”、“<”或“=”)。
(4)金属镍能与CO反应生成一种配合物Ni(CO)4(常温下为无色液体)。Ni(CO)4的固体属于_____晶体,Ni与CO之间的化学键称为__________,提供孤对电子的成键原子是_________。(填元素符号)
(5)一种钛镍合金的立方晶胞结构如图所示:
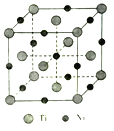
①该合金中Ti的配位数为________。
②若合金的密度为d g/cm3,晶胞边长a=________pm。(用含d的计算式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对可逆反应2A(s)+3B(g) ![]() C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
C(g)+2D(g) ΔH<0,在一定条件下达到平衡,下列有关叙述正确的是( )
①增加A的量,平衡向正反应方向移动
②升高温度,平衡向逆反应方向移动,v(正)减小
③压强增大一倍,平衡不移动,v(正)、v(逆)不变
④增大B的浓度,v(正)>v(逆)
⑤加入催化剂,B的转化率提高
A.①②B.④C.③D.④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com