
【题目】我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,直到近年来人们才研究出来其成分BaCuSi4O10,BaCuSi2O6。
(1)“中国蓝”、“中国紫”中均具有Cun+离子,n=___。
(2)在5500年前,古代埃及人就己经知道如何合成蓝色颜料—“埃及蓝”CaCuSi4O10,其合成原料中用CaCO3代替了BaCO3,其它和“中国蓝”一致。CO32一中键角∠OCO为___。根据所学,从原料分解的角度判断“埃及蓝”的合成温度比“中国蓝”更___(填“高”或“低”)。
(3)CaCux合金可看作由如图所示的(a)、(b)两种原子层交替堆积排列而成。(a)是由Cu和Ca共同组成的层,层中Cu—Cu之间由实线相连;(b)是完全由Cu原子组成的层,Cu—Cu之间也由实线相连。图中虚线构建的六边形,表示由这两种层平行堆积时垂直于层的相对位置;(c)是由(a)和(b)两种原子层交替堆积成CaCux合金的晶体结构图。在这种结构中,同一层的Ca—Cu距离为294pm,相邻两层的Ca—Cu距离为327pm。
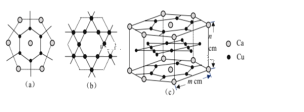
①该晶胞中Ca有___个Cu原子配位(不一定要等距最近)。
②同一层中,Ca原子之间的最短距离是______pm,设NA为阿伏加德罗常数的值,CaCux晶体的密度是_____g/cm3(用含m、n的式子表示)。
【答案】2 120° 低 18 ![]()
![]()
【解析】
(1)根据化合物中所有元素的化合价代数和为0可计算出Cu的化合价,即+2+n+4![]() 4-2
4-2![]() 10=0,n=2;
10=0,n=2;
(2)碳酸根中C原子属于sp2杂化,平面正三角形,键角为120°,对于碱土金属碳酸盐的热稳定性BaCO3比CaCO3稳定性弱,因为Ba的金属性比Ca强,故合成“埃及蓝”的温度比合成“中国蓝”的温度低;
(3)①以上面面心上的Ca原子为例,该晶胞中Ca原子配位的Cu原子包含上面6个、相同层6个、下层6个,所以其配位数为18;
②同一层中,六边形中心的Ca原子和边上的两个Ca原子形成正三角形,所以Ca原子之间最短距离是六边形边长=![]() =
=![]() =
=![]() ;该晶胞中Ca原子个数=
;该晶胞中Ca原子个数=![]() =3、Cu原子个数=
=3、Cu原子个数=![]() =15,该晶胞体积=
=15,该晶胞体积=![]() cm3=
cm3=![]() cm3,晶体密度=
cm3,晶体密度= 。
。


科目:高中化学 来源: 题型:
【题目】(1)普鲁士蓝的化学式是KFe[Fe(CN)6],该物质的化学键有离子键、共价键和_____。
(2)KOCN是离子晶体;碳原子采取sp杂化,1mol该物质中含有的π键数目为____。
(3)H2O2常温下是液体,沸点较高(150℃),其主要原因是____。
(4)非金属元素![]() 的第一电离能大于
的第一电离能大于![]() 的第一电离能,原因是______。
的第一电离能,原因是______。
(5)V2O5溶于NaOH溶液,可得到钒酸钠(Na3VO4),该盐阴离子的立体构型为________。
(6)已知食盐的密度为ρ g·cm-3,其摩尔质量为M g·mol-1,阿伏加德罗常数为NA,则在食盐晶体晶胞参数是_______cm。
(7)1 mol SiO2晶体中含________ mol Si—O键。
(8)1 mol NH4BF4含有________ mol配位键。
(9)冰、金刚石、MgO、CaCl2、干冰5种晶体的熔点由高到低的顺序为:_____________。
(10)体心立方结构的金属如:Na、K、Fe的晶胞的空间占有率表达式为________(含π)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋中有丰富的食品、矿产、能源、药物和水产资源等(如图所示),

下列有关说法正确的是
A.第①步中除去粗盐中的![]() 、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为: Na2CO3溶液→BaCl2溶液→NaOH溶液→过滤→适量盐酸调pH
、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为: Na2CO3溶液→BaCl2溶液→NaOH溶液→过滤→适量盐酸调pH
B.MgSO4·7H2O在空气中加热可制得无水MgSO4的方法与第②步相似。
C.从第③步到第⑤步的目的是为了浓缩富集Br2
D.在第③④⑤步中溴元素均被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,在2 L密闭容器中充入4 mol A气体和3 mol B气体,发生下列反应:2A(g)+B(g)![]() C(g)+xD(g),5 s达到平衡。达到平衡时,生成了1 mol C,测定D的浓度为1 mol·L-1。
C(g)+xD(g),5 s达到平衡。达到平衡时,生成了1 mol C,测定D的浓度为1 mol·L-1。
(1)求x=_____。
(2)求这段时间A的平均反应速率为_____。
(3)平衡时A的转化率为_____。
(4)下列叙述能说明上述反应达到平衡状态的是_____
A. 单位时间内每消耗2 mol A,同时生成1 mol C
B. 单位时间内每生成1 molB,同时生成1 molC
C. D的体积分数不再变化
D. 混合气体的压强不再变化
E. B、C 的浓度之比为1:1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种新型的合成氨的方法如图所示,下列说法错误的是
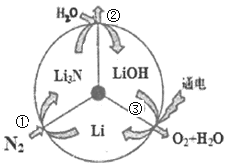
A.反应①属于“氮的固定”
B.反应②属于非氧化还原反应
C.反应③可通过电解LiOH水溶液实现
D.上述三步循环的总反应方程式为2N2+6H2O=4NH3+3O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂离子电池应用很广。某种锂离子二次电池的电极材料主要是钴酸锂(LiCoO2)和石墨。钴是一种稀有的贵重金属,废旧锂离子电池电极材料的回收再生意义重大。
(1)锂离子电池(又称锂离子浓差电池)的充电过程:Li+从含LiCoO2的电极中脱出,正三价Co被氧化,此时该极处于贫锂态(Li1-xCoO2)。
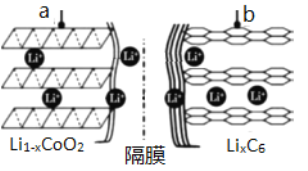
①充电时,a极的电极反应式为____________________________________。
②放电时,电流从______(填“a”或“b”)极流出。
(2)钴酸锂回收再生流程如下:

①H2SO4酸浸时,通常添加30%的H2O2以提高浸出效率,其中H2O2的作用是_______________。
②用盐酸代替H2SO4和H2O2,浸出效率也很高,但工业上不使用盐酸,主要原因之一是:会产生有毒、有污染的气体。写出相应反应的化学方程式______________________________。
③高温下,在O2存在时纯净的CoC2O4与Li2CO3再生为LiCoO2的化学方程式为_______________。
(3)已知下列热化学方程式:
Fe2O3(s)+3CO(g)===2Fe(s)+3CO2(g) ΔH1=-25 kJ·mol-1
3Fe2O3(s)+CO(g)===2Fe3O4(s)+CO2(g) ΔH2=-47 kJ·mol-1
Fe3O4(s)+CO(g)===3FeO(s)+CO2(g) ΔH3=+19 kJ·mol-1
写出FeO(s)被CO还原成Fe和CO2的热化学方程式_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.1mol乙基中含有的电子数为16NA
B.8g CH4中含有10NA个电子
C.标准状况下22.4L氯仿中共价键数目为4NA
D.28g乙烯、丙烯、丁烯的混合气体,其碳原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苯乙烯是重要的基础有机化工原料。工业中以乙苯(C6H5—CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5—CH=CH2),反应的化学方程式为C6H5—CH2CH3(g)![]() C6H5—CH=CH2(g)+H2(g) ΔH=a kJ·mol-1。
C6H5—CH=CH2(g)+H2(g) ΔH=a kJ·mol-1。
(1)乙苯在特定催化剂下发生氧化脱氢:C6H5—CH2CH3(g)+1/2O2(g)![]() C6H5—CH=CH2(g)+H2O(g) ΔH1
C6H5—CH=CH2(g)+H2O(g) ΔH1
已知H2的燃烧热ΔH=b kJ·mol-1,水的汽化热为c J·g-1,则ΔH1=________。
(2)①在汽车上安装三元催化转化器可实现反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH<0。则该反应在________(填“高温”“低温”或“任何温度”)下能自发进行。
N2(g)+2CO2(g) ΔH<0。则该反应在________(填“高温”“低温”或“任何温度”)下能自发进行。
②在某温度下,2 L密闭容器中充入NO、CO各0.4 mol进行反应,测得NO物质的量变化如图所示,5 min末反应达到平衡。第6 min继续加入0.2 mol NO、0.2 mol CO、0.2 mol CO2和0.3 mol N2,请在图中画出到9 min末反应达到平衡NO的物质的量随时间的变化曲线_______________。

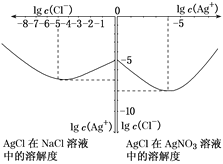
(3)沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。已知AgCl+Cl-=[AgCl2]-,下图是某温度下AgCl在NaCl溶液中的溶解情况。
①由图知,该温度下AgCl的溶度积常数为________。
②AgCl在NaCl溶液中的溶解度出现如图所示情况(先变小后变大)的原因是:______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)可用作分析试剂及鞣革还原剂。它受热、遇酸易分解。工业上可用反应:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2制得。实验室模拟该工业过程的装置如图所示。
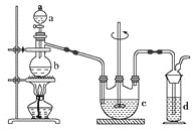
回答下列问题:
(1)a中试剂为__________,b中试剂为__________,c中试剂为____________________。
(2)反应开始后,c中先有浑浊产生,后又变澄清。此浑浊物是______________。
(3)d中的试剂为__________________。
(4)实验中要控制SO2生成速率,可以采取的措施有________________(写出两条)。
(5)为了保证硫代硫酸钠的产量,实验中通入的SO2不能过量,原因是__________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com