
【题目】苯乙烯是重要的基础有机化工原料。工业中以乙苯(C6H5—CH2CH3)为原料,采用催化脱氢的方法制取苯乙烯(C6H5—CH=CH2),反应的化学方程式为C6H5—CH2CH3(g)![]() C6H5—CH=CH2(g)+H2(g) ΔH=a kJ·mol-1。
C6H5—CH=CH2(g)+H2(g) ΔH=a kJ·mol-1。
(1)乙苯在特定催化剂下发生氧化脱氢:C6H5—CH2CH3(g)+1/2O2(g)![]() C6H5—CH=CH2(g)+H2O(g) ΔH1
C6H5—CH=CH2(g)+H2O(g) ΔH1
已知H2的燃烧热ΔH=b kJ·mol-1,水的汽化热为c J·g-1,则ΔH1=________。
(2)①在汽车上安装三元催化转化器可实现反应:2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH<0。则该反应在________(填“高温”“低温”或“任何温度”)下能自发进行。
N2(g)+2CO2(g) ΔH<0。则该反应在________(填“高温”“低温”或“任何温度”)下能自发进行。
②在某温度下,2 L密闭容器中充入NO、CO各0.4 mol进行反应,测得NO物质的量变化如图所示,5 min末反应达到平衡。第6 min继续加入0.2 mol NO、0.2 mol CO、0.2 mol CO2和0.3 mol N2,请在图中画出到9 min末反应达到平衡NO的物质的量随时间的变化曲线_______________。

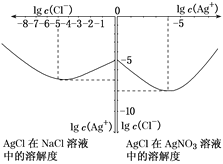
(3)沉淀物并非绝对不溶,且在水及各种不同的溶液中溶解度有所不同,同离子效应、络合物的形成等都会使沉淀物的溶解度有所改变。已知AgCl+Cl-=[AgCl2]-,下图是某温度下AgCl在NaCl溶液中的溶解情况。
①由图知,该温度下AgCl的溶度积常数为________。
②AgCl在NaCl溶液中的溶解度出现如图所示情况(先变小后变大)的原因是:______________________。
【答案】(a+b+0.018c)kJ·mol-1 低温 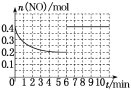 10-12 开始Cl-抑制了AgCl的溶解,AgCl的溶解度变小,但c(Cl-)增大使AgCl形成[AgCl2]-络合物,所以AgCl的溶解度又变大
10-12 开始Cl-抑制了AgCl的溶解,AgCl的溶解度变小,但c(Cl-)增大使AgCl形成[AgCl2]-络合物,所以AgCl的溶解度又变大
【解析】
(1)由H2的燃烧热ΔH=b kJ·mol-1,得:①H2(g)+1/2O2(g)=H2O(l) ΔH=b kJ·mol-1,由水的汽化热为c J·g-1,即0.018c kJ·mol-1,得:②H2O(l)=H2O(g) ΔH=0.018c kJ·mol-1,又知③C6H5-CH2CH3(g)![]() C6H5—CH=CH2(g)+H2(g) ΔH1=a kJ·mol-1;根据盖斯定律,由③+①+②得:C6H5—CH2CH3(g)+1/2O2(g)
C6H5—CH=CH2(g)+H2(g) ΔH1=a kJ·mol-1;根据盖斯定律,由③+①+②得:C6H5—CH2CH3(g)+1/2O2(g)![]() C6H5—CH=CH2(g)+H2O(g),即可求出ΔH。
C6H5—CH=CH2(g)+H2O(g),即可求出ΔH。
(2)①反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH<0的正反应是气体体积减小的反应,ΔS<0,低温下满足ΔH-TΔS<0,即在低温时反应自发进行;②由题意知反应为2NO(g)+2CO(g)
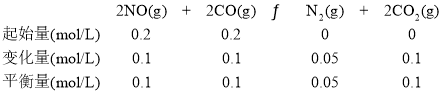
N2(g)+2CO2(g) ΔH<0的正反应是气体体积减小的反应,ΔS<0,低温下满足ΔH-TΔS<0,即在低温时反应自发进行;②由题意知反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g),2 L密闭容器中充入NO、CO各0.4 mol,达到平衡时NO为0.2 mol。
N2(g)+2CO2(g),2 L密闭容器中充入NO、CO各0.4 mol,达到平衡时NO为0.2 mol。
将数据代入公式K=![]() ,即可求出K。
,即可求出K。
第6 min继续加入0.2 mol NO,0.2 mol CO、0.2 mol CO2、0.3 mol N2,此时,c(NO)=c(CO)=c(CO2)=c(N2)=0.2 mol·L-1,将数据代入公式Q=![]() ,并将数值与K进行比较,即可说明平衡移动情况;第6 min继续加入0.2 mol NO、0.2 mol CO、0.2 mol CO2和0.3 mol N2,依据平衡移动情况,确定NO的物质的量变化,从而绘出坐标图象。
,并将数值与K进行比较,即可说明平衡移动情况;第6 min继续加入0.2 mol NO、0.2 mol CO、0.2 mol CO2和0.3 mol N2,依据平衡移动情况,确定NO的物质的量变化,从而绘出坐标图象。
(3)①由题图2可知,当c(Ag+)=10-5 mol·L-1时,c(Cl-)=10-7 mol·L-1,代入AgCl的溶度积常数公式Ksp=c(Ag+)·c(Cl-),即可求出结果;②根据沉淀溶解平衡:AgCl(s) ![]() Cl-(aq)+Ag+(aq),将AgCl放在NaCl溶液中,起初是同离子效应,后来是发生反应AgCl+Cl-=[AgCl2]-。
Cl-(aq)+Ag+(aq),将AgCl放在NaCl溶液中,起初是同离子效应,后来是发生反应AgCl+Cl-=[AgCl2]-。
(1)由H2的燃烧热ΔH=b kJ·mol-1,得:①H2(g)+1/2O2(g)=HO(l) ΔH=b kJ·mol-1,由水的汽化热为c J·g-1,即0.018c kJ·mol-1,得:②H2O(l)=H2O(g) ΔH=0.018c kJ·mol-1,又知③C6H5-CH2CH3(g)![]() C6H5—CH=CH2(g)+H2(g) ΔH1=a kJ·mol-1;根据盖斯定律,由③+①+②得:C6H5—CH2CH3(g)+1/2O2(g)
C6H5—CH=CH2(g)+H2(g) ΔH1=a kJ·mol-1;根据盖斯定律,由③+①+②得:C6H5—CH2CH3(g)+1/2O2(g)![]() C6H5—CH=CH2(g)+H2O(g),故ΔH=a kJ·mol-1+b kJ·mol-1+0.018c kJ·mol-1=(a+b+0.018c)kJ·mol-1。答案为:(a+b+0.018c)kJ·mol-1;
C6H5—CH=CH2(g)+H2O(g),故ΔH=a kJ·mol-1+b kJ·mol-1+0.018c kJ·mol-1=(a+b+0.018c)kJ·mol-1。答案为:(a+b+0.018c)kJ·mol-1;
(2)①反应2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ΔH<0的正反应是气体体积减小的反应,ΔS<0,低温下满足ΔH-TΔS<0,即在低温时反应自发进行;答案为:低温;
N2(g)+2CO2(g) ΔH<0的正反应是气体体积减小的反应,ΔS<0,低温下满足ΔH-TΔS<0,即在低温时反应自发进行;答案为:低温;
②由题意知反应为2NO(g)+2CO(g)![]() N2(g)+2CO2(g),2 L密闭容器中充入NO、CO各0.4 mol,达到平衡时NO为0.2 mol。
N2(g)+2CO2(g),2 L密闭容器中充入NO、CO各0.4 mol,达到平衡时NO为0.2 mol。

K=![]() =5,第6 min继续加入0.2 mol NO,0.2 mol CO、0.2 mol CO2、0.3 mol N2,此时,c(NO)=c(CO)=c(CO2)=c(N2)=0.2 mol·L-1,Q=
=5,第6 min继续加入0.2 mol NO,0.2 mol CO、0.2 mol CO2、0.3 mol N2,此时,c(NO)=c(CO)=c(CO2)=c(N2)=0.2 mol·L-1,Q=![]() =5=K,说明是平衡状态,所以第6 min继续加入0.2 mol NO、0.2 mol CO、0.2 mol CO2和0.3 mol N2,仍是平衡状态,但是NO的物质的量变为原来的2倍。则9 min末反应达到平衡NO的物质的量随时间的变化曲线为
=5=K,说明是平衡状态,所以第6 min继续加入0.2 mol NO、0.2 mol CO、0.2 mol CO2和0.3 mol N2,仍是平衡状态,但是NO的物质的量变为原来的2倍。则9 min末反应达到平衡NO的物质的量随时间的变化曲线为 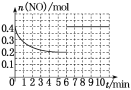 。答案为:
。答案为: ;
;
(3)①由题图2可知,当c(Ag+)=10-5 mol·L-1时,c(Cl-)=10-7 mol·L-1,AgCl的溶度积常数Ksp=c(Ag+)·c(Cl-)=10-5×10-7=10-12;答案为:10-12;
②根据沉淀溶解平衡:AgCl(s) ![]() Cl-(aq)+Ag+(aq),将AgCl放在NaCl溶液中,Cl-抑制了AgCl的溶解,但随c(Cl-)增大,发生反应AgCl+Cl-=[AgCl2]-,使AgCl的溶解度增大。答案为:开始Cl-抑制了AgCl的溶解,AgCl的溶解度变小,但c(Cl-)增大使AgCl形成[AgCl2]-络合物,所以AgCl的溶解度又变大。
Cl-(aq)+Ag+(aq),将AgCl放在NaCl溶液中,Cl-抑制了AgCl的溶解,但随c(Cl-)增大,发生反应AgCl+Cl-=[AgCl2]-,使AgCl的溶解度增大。答案为:开始Cl-抑制了AgCl的溶解,AgCl的溶解度变小,但c(Cl-)增大使AgCl形成[AgCl2]-络合物,所以AgCl的溶解度又变大。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】已知有以下的物质相互转化关系,A是常见的金属单质,能被磁铁吸引.
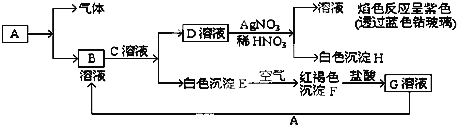
(1)试回答:写出B的化学式__________C的化学式__________H的化学式__________
(2)写出由E转变成F的化学方程式__________.
(3)向G溶液加入A的有关离子反应方程式__________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国秦俑彩绘和汉代器物上用的颜料被称为“中国蓝”、“中国紫”,直到近年来人们才研究出来其成分BaCuSi4O10,BaCuSi2O6。
(1)“中国蓝”、“中国紫”中均具有Cun+离子,n=___。
(2)在5500年前,古代埃及人就己经知道如何合成蓝色颜料—“埃及蓝”CaCuSi4O10,其合成原料中用CaCO3代替了BaCO3,其它和“中国蓝”一致。CO32一中键角∠OCO为___。根据所学,从原料分解的角度判断“埃及蓝”的合成温度比“中国蓝”更___(填“高”或“低”)。
(3)CaCux合金可看作由如图所示的(a)、(b)两种原子层交替堆积排列而成。(a)是由Cu和Ca共同组成的层,层中Cu—Cu之间由实线相连;(b)是完全由Cu原子组成的层,Cu—Cu之间也由实线相连。图中虚线构建的六边形,表示由这两种层平行堆积时垂直于层的相对位置;(c)是由(a)和(b)两种原子层交替堆积成CaCux合金的晶体结构图。在这种结构中,同一层的Ca—Cu距离为294pm,相邻两层的Ca—Cu距离为327pm。
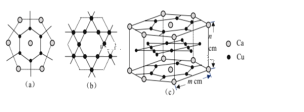
①该晶胞中Ca有___个Cu原子配位(不一定要等距最近)。
②同一层中,Ca原子之间的最短距离是______pm,设NA为阿伏加德罗常数的值,CaCux晶体的密度是_____g/cm3(用含m、n的式子表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用微生物可将废水中苯酚的化学能直接转化为电能,装置如图所示。电池工作时,下列说法正确的是( )
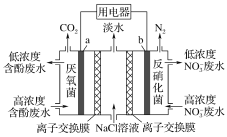
A.a极为正极,发生氧化反应
B.b极的电极反应式为:2NO![]() +12H+-10e-=N2↑+6H2O
+12H+-10e-=N2↑+6H2O
C.中间室的Cl-向左室移动
D.左室消耗苯酚(C6H5OH)9.4 g时,用电器流过2.4 mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Z、Y为核电荷数依次增大的前20号主族元素,W的原子中只有1个电子,X与Y同族,Y的一种单质在空气中易自燃,W与Z形成的二元化合物和水反应可生成W的单质。下列说法正确的是![]()
A.W分别与Y、Z形成的化合物中化学键类型相同
B.Y的氧化物的水化物是强酸
C.氢化物沸点:![]()
D.简单离子半径:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】
钛镍形状记忆合金(TiNi)被广泛用于人造卫星和宇宙飞船的天线,在临床医疗领域内也具有广泛的应用。回答下列问题:
(1)写出基态Ti原子的电子排布式:_________,Ni在元素周期表中的位置是_________。
(2)钛镍合金能溶于热的硫酸生成Ti(SO4)2、NiSO4,二者阴离子的立体构型为______,中心原子的轨道杂化类型是_______。
(3)工业上将金红石(主要成分TiO2)转化为液态TiCl4,再用金属镁在高温下还原得到金属钛,同时生成MgCl2。
①MgCl2的熔沸点比TiCl4高得多,其原因是______。
②原子半径r(Cl)_____r(Mg),离子半径r(O2-)______r(Mg2+)(填“>”、“<”或“=”)。
(4)金属镍能与CO反应生成一种配合物Ni(CO)4(常温下为无色液体)。Ni(CO)4的固体属于_____晶体,Ni与CO之间的化学键称为__________,提供孤对电子的成键原子是_________。(填元素符号)
(5)一种钛镍合金的立方晶胞结构如图所示:
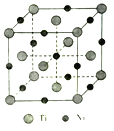
①该合金中Ti的配位数为________。
②若合金的密度为d g/cm3,晶胞边长a=________pm。(用含d的计算式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E五种物质是含钠元素的单质或化合物,其中B为淡黄色固体,它们有如图所示的转化关系:

(1)推断各符号所代表的物质的化学式:
A____________,B____________,C____________,D____________,E____________。
(2)分别写出反应②、⑤的化学方程式:
②______________________________________,
⑤__________________________________________。
(3)写出反应③的离子方程式____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A.苯酚钠的溶液中通入过量CO2:2![]() +CO2+H2O→CO32-+2
+CO2+H2O→CO32-+2![]()
B.NaOH溶液中加入少量苯酚:C6H5OH+OH-→C6H5O-+H2O
C.银氨溶液中加入少量乙醛溶液,水浴加热:CH3CHO+2Ag(NH3)2++2OH-![]() CH3COONH4+2Ag↓+3NH3+H2O
CH3COONH4+2Ag↓+3NH3+H2O
D.乙酸钠溶液加入少量盐酸:CH3COONa+H+→CH3COOH+Na+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W、R、Q是原子序数依次增大的前20号元素。X2是通常状况下密度最小的气体;Z与R同主族,R的一种固体单质在空气中易自燃;Y、W最外层电子数之和是Z的2倍,W有W2、W3两种常见单质;含Q的化合物焰色反应呈紫色。请回答下列问题:
(1)X、W、R、Q原子半径由大到小的顺序是(写元素符号)__________;请写出Z在周期表中的位置____________________。
(2)由上述元素组成的物质YW(ZX2)2是一种中性肥料,请写出它的电子式______________。
(3)请设计实验比较Z与R元素的非金属性强弱____________________。
(4)X、Y形成的化合物中含有非极性键且相对分子质量最小的物质是________。(写化学式)
(5)R的简单氢化物具有强还原性,将其通入硫酸铜溶液能生成两种最高价含氧酸和一种单质,请写出该反应的化学方程式__________________________________________________。
(6)Y的最高价氧化物与Q的最高价氧化物的水化物按物质的量之比1:2反应,所得溶液中离子浓度由大到小的顺序____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com