
【题目】二甘醇可用作溶剂、纺织助剂等,一旦进入人体会导致急性肾衰竭,危及生命。二甘醇的结构简式是HOCH2CH2OCH2CH2OH。下列有关二甘醇的叙述正确的是
A.符合通式CnH2nO3
B.能溶于水,不溶于乙醇
C.分子间不存在范德华力
D.分子间能形成氢键
科目:高中化学 来源: 题型:
【题目】下列各组离子可能大量共存的是
A.常温下Kw/c(H+)=1×10-13mol·L-1的溶液中:Ca2+、Fe2+、NO![]() 、NH
、NH![]()
B.水电离出的c(H+)=10-10mol·L—1的溶液中Na+、K+、Cl、HCO3
C.pH=11的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32-
D.c(Fe3+)=0.1mol·L-1的溶液中:K+、Cl-、SO42-、H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期主族元素X、Y、Z、W的原子序数依次增大,X原子核外最外层电子数是其电子层数的2倍;Y的气态氢化物可以使湿润的红色石蕊试纸变蓝;液态Z可作为核反应堆的热传导剂;W与X原子最外层电子数之比为3∶2。下列说法正确的是( )
A. 化合物Z2O2含有离子键和极性共价键
B. 原子半径大小:W>Z>X>Y
C. WO2能使品红溶液褪色,其漂白原理与氯水类似
D. Y的气态氢化物与其最高价氧化物的水化物可反应生成盐
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如下方案,以分离KCl和BaCl2两种固体混合物,试回答问题:
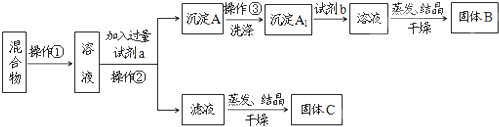
(1)操作①的名称是 ,操作②的名称是 。
(2)试剂a是 ,试剂b是 ,固体B是 。(填化学式)
(3)加入试剂b所发生的化学反应方程式为: 。
(4)该方案是否达到实验目的: (填“是”或“否”)。若不能,应如何改进(若能,此问不用回答 。
(5)若要测定原混合物中KCl和BaCl2的质量分数,除了要准确称量混合物的质量外,至少还要获得的数据是 (填“A”、“A1”、“B”、“C”)的质量。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50ml0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。
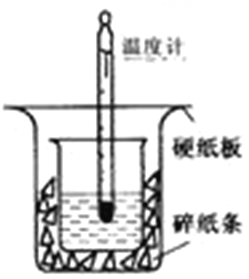
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是_______。装置中还存在的2个错误是 。
(2)在实验过程中,该同学需要测定并记录的实验数据有 (填序号)。
A盐酸的浓度 B盐酸的温度
C氢氧化钠溶液的浓度 D氢氧化钠溶液的温度
E水的比热容 F反应后混合溶液的终止温度
(3)使用补全仪器后的装置进行实验,取50ml0.50mol·L-1盐酸与50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃。已知中和后生成的溶液的 比热容为4.18J/(g·℃),溶液的密度均为1g/cm3。通过计算可得中和热△H= 。
(4)实验中改用60mL0.50mol·L-1盐酸跟50mL0.55mol·L-1NaOH溶液进行反应,与上述正确的实验操作相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会 ;(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙是两种常见短周期元素的单质,有关物质的转化关系如图所示。下列有关说法,错误的是( )
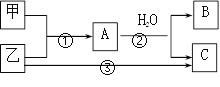
A. 若C为酸性气体,则B可能具有两性
B. 若C是碱性气体,则B一定是碱
C. 若B、C是两种酸,则B、C一定都是一元酸
D. 以上3个转变可能都是氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气和氨气在常温下混合即可发生反应。某兴趣小组同学为探究纯净、干燥的氯气与氨气的反应,设计了如下装置:
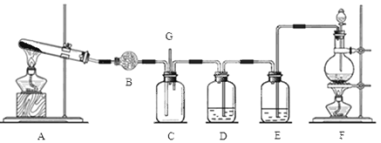
(1)装置F中发生反应的离子方程式是 ;
(2)装置D中盛放的试剂是 ,其作用是 ;
(3)A装置还可用于制取气体 (只填一种);
(4)若有10.7gNH4Cl,最多可制取标准状况下的氨气的体积是 L;
(5)装置C中有白烟产生,试写出反应的化学方程式 ;
(6)G处逸出的尾气中含有少量Cl2,为防止其污染环境,可将尾气通过盛有 的洗气瓶。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
①由H2、I2蒸气、HI气体组成的平衡体系加压后颜色变深
②黄绿色的氯水光照后颜色变浅
③使用催化剂可加快SO2转化为SO3的速率
④在含有Fe(SCN)3的红色溶液中加铁粉,振荡静置,溶液颜色变浅或褪去
A.②③ B.②④ C.①③ D.①④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.一定条件下,0.2 mol SO2与足量O2充分反应,生成SO3分子数为0.2NA
B.0.1 mol —NH2(氨基)中含有的电子数为0.7NA
C.3.4 g H2O2中含有的共用电子对数为0.1NA
D.常温常压下,16 g O2和O3混合气体含有的氧原子数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com