
����Ŀ��50ml0.50mol��L-1������50mL0.55mol��L-1NaOH��Һ������ͼ��ʾ��װ���н����кͷ�Ӧ��ͨ���ⶨ��Ӧ�����зų��������ɼ����к��ȡ�
�ش��������⣺
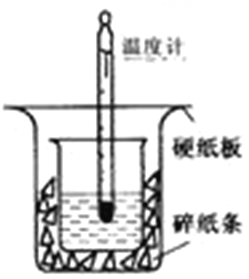
��1����ʵ��װ���Ͽ���ͼ����ȱ�ٵ�һ�ֲ���������_______��װ���л����ڵ�2�������� ��
��2����ʵ������У���ͬѧ��Ҫ�ⶨ����¼��ʵ�������� ������ţ���
A�����Ũ�� B������¶�
C����������Һ��Ũ�� D����������Һ���¶�
Eˮ�ı����� F��Ӧ������Һ����ֹ�¶�
��3��ʹ�ò�ȫ�������װ�ý���ʵ�飬ȡ50ml0.50mol��L-1������50mL0��55 mol��L NaOH��Һ��С�ձ��н����кͷ�Ӧ������ʵ���¶�ƽ������3��4�档��֪�кͺ����ɵ���Һ�� ������Ϊ4��18J����g���棩����Һ���ܶȾ�Ϊ1g��cm3��ͨ������ɵ��к��ȡ�H= ��
��4��ʵ���и���60mL0��50mol��L-1�����50mL0��55mol��L-1NaOH��Һ���з�Ӧ����������ȷ��ʵ�������ȣ����ų������� �����ȡ�����ȡ����������к��� �����ȡ�����ȡ�����
��5������ͬŨ�Ⱥ�����İ�ˮ����NaOH��Һ��������ʵ�飬��õ��к�����ֵ�� �����ƫ��ƫС������Ӱ�족����
���𰸡���1�����β��������������С�ձ�δ����ձ�������ƽ���ձ���δ������ֽ��
��2��BDF��3��-56.8kJ��mol-1��4������� ��ȣ�5��ƫС
��������
�����������1�������ȼƵĹ����֪��װ�õ�ȱ�������ǻ��β�����������к��Ȳⶨʵ��ɰܵĹؼ��DZ��¹����������ձ�Ϊһ���ߣ���������ɢʧ�����2����������С�ձ�δ����ձ�������ƽ���ձ���δ������ֽ����
��2���ڸ�ʵ������У���ͬѧ��Ҫ�ⶨ��ʵ���������ᡢ��ij�ʼ�¶��Լ���Ӧ������Һ����ֹ�¶ȣ���Ϊ��BDF��
��3��50mL 0.50mol/L������50mL 0.55mol/L NaOH��Һ�кͷ�Ӧ����ˮ�����ʵ���Ϊ0.05L��0.50mol��0.025mol����Һ������Ϊ��100mL��1g/mL��100g���¶ȱ仯��ֵ��TΪ3.4����������0.025molˮ�ų�������ΪQ��mc��T��100g��4.18J/��g������3.4��=1421.2J������ʵ���õ��к�����H��-1.4212kJ/0.025mol����56.8kJ��mol-1��
��4����Ӧ�ų����������������Լ�������Ķ����йأ�����60mL 0.50mol/L�����50mL 0.55mol/L NaOH��Һ���з�Ӧ��������ʵ����ȣ�����ˮ�������࣬���ų�������ƫ�ߣ������к��ȵľ���ǿ���ǿ�Ӧ����1molˮʱ�ų����ȣ��к�����ȣ�
��5����ˮΪ����������Ϊ���ȹ��̣������ð�ˮ����ϡ����������Һ��Ӧ����Ӧ�ų�������ƫС��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ClO2������һ�ֳ��õ����������ҹ���2 000��������ClO2��������������ˮ����������
��1������ˮʱ��ClO2���ɽ�ˮ�е�Fe2����Mn2����ת����Fe(OH)3��MnO2���������ȥ������������У�Fe2����Mn2���Ļ��ϼ����ߣ�˵��ClO2����__________�ԡ�
��2����ҵ�Ͽ���ͨ�����з�����ȡClO2������ɸû�ѧ��Ӧ����ʽ��
2KClO3��SO2=2ClO2��__________��
��3��ʹCl2��H2O(g)ͨ�����ȵ�̿�㣬����HCl��CO2���Ƿ��ȷ�Ӧ����1 mol Cl2���뷴Ӧʱ �ͷ�145 kJ��������д�������Ӧ���Ȼ�ѧ����ʽ��________________��
��4������ˮ����ClO2�������ˮ�У�Ҫ��ClO2��Ũ����0��1��0��8 mg��L��1֮�䡣���������Լ� ��ˮ��ClO2��Ũ�ȣ��������£�
��ȡһ�������ˮ��������һ�����ĵ⻯�أ���������������Һ�������ԣ������������Һ����Һ������
������һ������Na2S2O3��Һ��(��֪��2S2O![]() ��I2=S4O
��I2=S4O![]() ��2I��)
��2I��)
���������ˮ��pH��1��3��
����ʱ����ͬpH������������������ͼ��ʾ��

��ش�
���������з�Ӧ�����ӷ���ʽ��___________________��
��ȷ����������ȫ��Ӧ��������___________________��
���ڲ���������У���Һ�ֳ���ɫ����Ӧ�����ӷ���ʽ��___________________��
����ˮ�������Ϊ1��0L���ڲ�����ʱ������1��0��10��3mol��L��1��Na2S2O3��Һ10mL����ˮ����ClO2��Ũ����________mg��L��1��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з����������ֱ���������ǣ� ��
A. �۲���ɫ B. ������Ʒ�Ӧ
C. �μ���ɫʯ����Һ D. �۲���ˮ�е��ܽ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�� ���Ϸ��ڵ�������Ҫ�ɷ��Ǽ���(�ṹʽΪ![]() ��Ka=1.8��10��4)��ͨ���������һ����ɫ�ӷ���Һ�塣������Ũ�������������ֽ����CO��ij��ѧ��ȤС���ͬѧ��HCOOH�����ʽ���������̽����
��Ka=1.8��10��4)��ͨ���������һ����ɫ�ӷ���Һ�塣������Ũ�������������ֽ����CO��ij��ѧ��ȤС���ͬѧ��HCOOH�����ʽ���������̽����
I������ͬѧѡ����ͼ1��ʾ��װ��̽��HCOOH��Ũ���������·ֽ������CO����������и�С�⡣
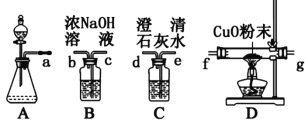

ͼ1 ͼ2
��д������ֽ�Ļ�ѧ����ʽ ��
��װ�õ�����˳��a ��
��HCOOH�ķֽ��������CO������ ��
����ʵ�������һ�����Ե�ȱ���� ��
II������ͬѧ�����˼�����ӽṹ����Ϊ�����ܷ���������Ӧ�����������ͼ2��ʾ��ʵ�顣
����ͼ��ʾ��ʵ�飬����20���Ӻ�û�г��ֹ����������������ʵ����û�в���������ԭ�� ��
�������ʵ������֤��Ľ��� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����϶���죬���õ��¡���ʵ�����л����塰�������¡���ΰ�����롣������³�̫���ܵ�ذ�İ뵼�������
A���� B���������� C�����Ͻ� D�����Ͻ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ʴ��������ܼ�����֯�����ȣ�һ����������ᵼ�¼�����˥�ߣ�Σ�����������ʴ��Ľṹ��ʽ��HOCH2CH2OCH2CH2OH�������йض��ʴ���������ȷ����
A������ͨʽCnH2nO3
B��������ˮ���������Ҵ�
C�����Ӽ䲻���ڷ��»���
D�����Ӽ����γ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ͬ��ͬѹ�£���A��B������ȫ��ͬ���������������Բ�������A�����г���a���壬 B�����г���b���壬������������������ȣ�A�������ڵ����У�����ֹ������B������������N2H4�������У����������������й���������ȷ����
A��a�������Է�������һ����b�������Է���������
B��a���������CO��b���������CH4
C��A�����������������������B�������������������
D��������A���������һ������B���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ͬʱ���뵽ˮ�У��ܴ��������ҵõ���ɫ����Һ����
A. K2CO3 BaCl2 NaOH B. CaCl2 HCl KNO3
C. KOH KCl (NH4)2SO4 D. Fe2O3 HCl NaNO3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������Ԫ��X��Y��Z��Wԭ��������������Xԭ������������������Ӳ�����3����Y��X���γ�Y2X2��Y2X�������ӻ����Zԭ�ӵĺ����������Yԭ�Ӷ�1��W��Xͬ���塣����˵����ȷ����( )
A�����ʵĻ�ԭ�ԣ�Y��Z
B��ԭ�Ӱ뾶��Y��Z��W
C����̬�⻯����ȶ��ԣ�X��W
D��Y��Z��������������Ӧ��ˮ���������Ӧ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com