
【题目】ClO2气体是一种常用的消毒剂,我国从2 000年起逐步用ClO2代替氯气对饮用水进行消毒。
(1)消毒水时,ClO2还可将水中的Fe2+、Mn2+等转化成Fe(OH)3和MnO2等难溶物除去,在这个过程中,Fe2+、Mn2+的化合价升高,说明ClO2具有__________性。
(2)工业上可以通过下列方法制取ClO2,请完成该化学反应方程式:
2KClO3+SO2=2ClO2+__________。
(3)使Cl2和H2O(g)通过灼热的炭层,生成HCl和CO2,是放热反应,当1 mol Cl2参与反应时 释放145 kJ的热量,写出这个反应的热化学方程式:________________。
(4)自来水厂用ClO2处理后的水中,要求ClO2的浓度在0.1~0.8 mg·L-1之间。碘量法可以检 测水中ClO2的浓度,步骤如下:
Ⅰ.取一定体积的水样,加入一定量的碘化钾,再用氢氧化钠溶液调至中性,并加入淀粉溶液,溶液变蓝。
Ⅱ.加入一定量的Na2S2O3溶液。(已知:2S2O![]() +I2=S4O
+I2=S4O![]() +2I-)
+2I-)
Ⅲ.加硫酸调节水样pH至1~3。
操作时,不同pH环境中粒子种类如下图所示:

请回答:
①操作Ⅰ中反应的离子方程式是___________________。
②确定操作Ⅱ完全反应的现象是___________________。
③在操作Ⅲ过程中,溶液又呈蓝色,反应的离子方程式是___________________。
④若水样的体积为1.0L,在操作Ⅱ时消耗了1.0×10-3mol·L-1的Na2S2O3溶液10mL,则水样中ClO2的浓度是________mg·L-1。
【答案】(1)氧化 (2)K2SO4
(3)2Cl2(g)+2H2O(g)+C(s)=4HCl(g)+CO2(g) ΔH=-290 kJ·mol-1
①2ClO2+2I-=2ClO2-+I2
②蓝色消失,且半分钟内不变色
③ClO2-+4I-+4H+=Cl-+2I2+2H2O④0.675
【解析】
试题分析:(1)Fe2+、Mn2+化合价都升高,说明ClO2作氧化剂;
(2)ClO3-中Cl的化合价由+5价→+4价,化合价降低,则SO2中S的化合价应升高,即转化成+6价,根据原子守恒,则应为K2SO4;
(3)①因为淀粉变蓝,说明有I2生成,根据不同pH的环境中粒子种类图,中性溶液Cl以ClO2-存在,ClO2+I-→I2+ClO2-,根据化合价升降法配平,即2ClO2+2I-=2ClO2-+I2;
②操作II是滴定实验,滴定到终点的现象是蓝色消失,且半分钟不变色;
③III中pH调节至1~3时,Cl以Cl-形式存在,溶液又变蓝,说明生成I2,ClO2-作氧化剂,因此有ClO2-+I-→Cl-+I2,根据化合价升降法配平,ClO2-+4I-→Cl-+2I2,因为溶液显酸性,H+作反应物参加反应,因此有ClO2-+4I-+4H+=Cl-+2I2+2H2O;
④根据离子反应方程式为:2ClO2~I2~2S2O32-,因此有n(ClO2)=n(S2O32-)=10×10-3×1.0×10-3×67.5mol,即浓度为10×10-3×1.0×10-3×67.5×103/1mg·L-1=0.675 mg·L-1。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列属于未来新能源标准的是
①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能
A.①②③④ B.⑤⑥⑦⑧
C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列对于过氧化钠的叙述中,正确的是( )
A. 将少量Na2O2投入紫色石蕊试液中,溶液最终呈蓝色
B. 1 mol Na2O2与H2O完全反应,转移2 mol电子
C. 充分加热等物质的量的Na2O2和NaHCO3的混合物,剩余物质为Na2CO3
D. a g CO和H2的混合气体充分燃烧的产物与足量的Na2O2充分反应后,固体质量增加a g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种物质有如下变化关系,E是淡黄色粉末,判断:
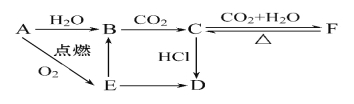
(1)写出B、C、D、F的化学式:
B. C. D. F. 。
(2)写出有关反应的离子方程式
B→C: ________________________________,
E→B: _______________________________,
F→C: _______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.在粗硅的制取中发生2C+SiO2![]() 2CO↑+Si,硅被还原,所以碳的还原性大于硅的还原性
2CO↑+Si,硅被还原,所以碳的还原性大于硅的还原性
B.硅酸钠属于盐,不属于碱,所以硅酸钠可以保存在磨口玻璃塞试剂瓶中
C.用SiO2制取硅酸,应先使二氧化硅与氢氧化钠溶液反应,然后再通入CO2
D.由Na2CO3+SiO2![]() CO2↑+Na2SiO3可知硅酸的酸性大于碳酸
CO2↑+Na2SiO3可知硅酸的酸性大于碳酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子可能大量共存的是
A.常温下Kw/c(H+)=1×10-13mol·L-1的溶液中:Ca2+、Fe2+、NO![]() 、NH
、NH![]()
B.水电离出的c(H+)=10-10mol·L—1的溶液中Na+、K+、Cl、HCO3
C.pH=11的溶液中:CO32-、Na+、AlO2-、NO3-、S2-、SO32-
D.c(Fe3+)=0.1mol·L-1的溶液中:K+、Cl-、SO42-、H2O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列措施不符合节能减排的是( )
A. 大力发展火力发电,解决电力紧张问题
B. 在屋顶安装太阳能热水器为居民提供生活用热水
C. 用石灰对煤燃烧后形成的烟气脱硫,并回收石膏
D. 用杂草、生活垃圾等有机废弃物在沼气池中发酵产生沼气,作家庭燃气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关组成生物体的化学元素和化合物的叙述,正确的是
A. 肌肉细胞中含量最多的化合物不是蛋白质
B. 组成核糖和核苷酸的化学元素完全相同
C. 动物与植物所含的化学元素含量和种类差异很大
D. 脂质是动物细胞的主要储能物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】50ml0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。
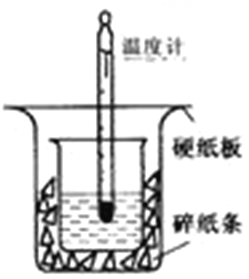
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是_______。装置中还存在的2个错误是 。
(2)在实验过程中,该同学需要测定并记录的实验数据有 (填序号)。
A盐酸的浓度 B盐酸的温度
C氢氧化钠溶液的浓度 D氢氧化钠溶液的温度
E水的比热容 F反应后混合溶液的终止温度
(3)使用补全仪器后的装置进行实验,取50ml0.50mol·L-1盐酸与50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃。已知中和后生成的溶液的 比热容为4.18J/(g·℃),溶液的密度均为1g/cm3。通过计算可得中和热△H= 。
(4)实验中改用60mL0.50mol·L-1盐酸跟50mL0.55mol·L-1NaOH溶液进行反应,与上述正确的实验操作相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会 ;(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com