
【题目】短周期元素X、Y、Z、W原子序数依次增大,X原子最外层电子数是其电子层数的3倍,Y与X可形成Y2X2和Y2X两种离子化合物,Z原子的核外电子数比Y原子多1,W与X同主族。下列说法正确的是( )
A.单质的还原性:Y>Z
B.原子半径:Y<Z<W
C.气态氢化物的稳定性:X<W
D.Y和Z两者最高价氧化物对应的水化物能相互反应
科目:高中化学 来源: 题型:
【题目】50ml0.50mol·L-1盐酸与50mL0.55mol·L-1NaOH溶液在如下图所示的装置中进行中和反应。通过测定反应过程中放出的热量可计算中和热。
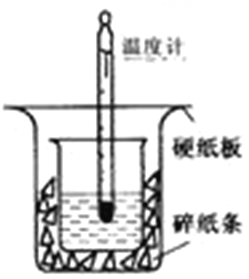
回答下列问题:
(1)从实验装置上看,图中尚缺少的一种玻璃仪器是_______。装置中还存在的2个错误是 。
(2)在实验过程中,该同学需要测定并记录的实验数据有 (填序号)。
A盐酸的浓度 B盐酸的温度
C氢氧化钠溶液的浓度 D氢氧化钠溶液的温度
E水的比热容 F反应后混合溶液的终止温度
(3)使用补全仪器后的装置进行实验,取50ml0.50mol·L-1盐酸与50mL0.55 mol/L NaOH溶液在小烧杯中进行中和反应,三次实验温度平均升高3.4℃。已知中和后生成的溶液的 比热容为4.18J/(g·℃),溶液的密度均为1g/cm3。通过计算可得中和热△H= 。
(4)实验中改用60mL0.50mol·L-1盐酸跟50mL0.55mol·L-1NaOH溶液进行反应,与上述正确的实验操作相比,所放出的热量 (填“相等”或“不相等”),所求中和热 (填“相等”或“不相等”)。
(5)用相同浓度和体积的氨水代替NaOH溶液进行上述实验,测得的中和热数值会 ;(填“偏大”“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列描述正确的是
A.“O”既可以表示宏观上的氧元素,也可以表示微观的一个氧原子
B.烧碱、纯碱按物质分类都属于碱
C.氧气、臭氧均为氧单质,所以物理性质、化学性质完全相同
D.泡沫灭火器的灭火原理是降低了可燃物的着火点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通常用燃烧的方法测定有机物的的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的质量确定有机物的组成。下图所示的是用燃烧法确定有机物分子式的常用装置。
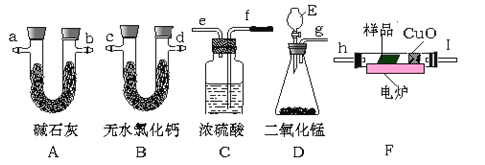
现准确称取1.8g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重1.76g,B管增重0.36g。请回答:
(1)用该方法可测定含有哪些元素和什么状态的有机物_________________;
(2)A、B管内均盛有固态试剂,B管的作用是__________________;
(3)产生的气体由左向右流向,所选用的各导管口连接的顺序是__________________。
(4)E中应盛装什么试剂:______________。
(5)如果把CuO网去掉,A管重量将_______;(填“增大”、“减小”、或“不变”)
(6)该有机物的最简式为__________________;
(7)要确定该有机物的分子式,还必须知道的数据是___________;
A.消耗液体E的质量
B.样品的摩尔质量
C.CuO固体减少的质量
D.C装置增加的质量
E.燃烧消耗O2的物质的量
(8)在整个实验开始之前,需先让D产生的气体通过整套装置一段时间,其目的是_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欲用98%的浓硫酸(ρ=1.84g/cm3)配制成浓度为0.5mol/L的稀硫酸240ml。
(1)在盛放浓硫酸的试剂瓶的标签上应印有下列警示标志中的____________。

(2)选用的主要仪器有:__________
①烧杯,②玻璃棒,③量筒,④胶头滴管,⑤____________。
(3)请将下列各操作,按正确的序号填在横线上。
A.用量筒量取浓H2SO4
B.反复颠倒摇匀
C.用胶头滴管加蒸馏水至凹液面恰好与刻度线相切
D.稀释浓H2SO4
E.将冷却后的稀释液转入容量瓶
F.将蒸馏水注入容量瓶,直到液面距刻度线1-2cm处
G.用少量蒸馏水洗涤烧杯和玻璃棒2-3次,并将洗涤液注入容量瓶,轻轻摇动容量瓶,使溶液混合均匀,其操作正确的顺序依次为____________________________。
(4)简要回答下列问题:
①所需浓硫酸的体积为____________mL,如果实验室有10mL、20mL、50mL的量筒应选用____________mL的量筒最好
②下列操作使所配溶液浓度偏高的是__________
A.用水洗涤量取浓硫酸的量筒,并将洗涤液转入容量瓶中
B.用量筒来量取浓硫酸,读数时,俯视量筒
C.搅拌过程中有液体溅出
D.在转入容量瓶前烧杯中液体未冷却至室温
E.定容时,俯视刻度线
F.容量瓶用蒸馏水洗净后未经干燥马上用来配制溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数的值。下列说法正确的是( )
A.一定条件下,0.2 mol SO2与足量O2充分反应,生成SO3分子数为0.2NA
B.0.1 mol —NH2(氨基)中含有的电子数为0.7NA
C.3.4 g H2O2中含有的共用电子对数为0.1NA
D.常温常压下,16 g O2和O3混合气体含有的氧原子数为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于在一定条件下密闭容器中进行的反应N2+3H2![]() 2NH3,下列有关推断正确的是( )
2NH3,下列有关推断正确的是( )
A.3mol H2与足量的N2在该容器内充分反应可生成2mol NH3
B.当生成N2和NH3的速率之比为1:2时反应处于平衡状态
C.在相同的温度和压强下,与不使用催化剂相比,使用催化剂可以提高平衡混合物中 NH3的含量
D.当反应速率之比v(N2): v(H2): v(NH3)=1:3:2时,反应处于平衡状态
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】环保、安全的铝空气电池的工作原理如图所示,下列有关叙述错误的是( )
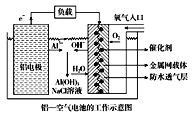
A. NaCl的作用是增强溶液的导电性
B. 正极的电极反应式为O2+4e-+2H2O=4OH-
C. 电池工作过程中,电解质溶液的pH不断增大
D. 用该电池做电源电解KI溶液制取1 mol KIO3,消耗铝电极的质量为54 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)实验室用Na2CO310H2O晶体配制0.05mol/L的Na2CO3溶液970mL,应选用的容量瓶的规格 ,称取Na2CO310H2O的质量是 g。
(2)2molO3和3molO2的质量之比为 ,分子数之比为 ,同温同压下的密度之比为 ,含氧原子数之比为 。
(3)现有下列九种物质①AgCl ②铜 ③液态醋酸 ④CO2 ⑤H2SO4 ⑥Ba(OH)2固体 ⑦酒精 ⑧稀硝酸 ⑨熔融FeCl3
①上述状态下可导电的是(填序号,下同) ,属于电解质的是 ,属于非电解质的是 。
②上述九种物质中有两种物质之间可发生离子反应H++OH-=H2O,该离子反应对应的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com