
【题目】通常用燃烧的方法测定有机物的的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的质量确定有机物的组成。下图所示的是用燃烧法确定有机物分子式的常用装置。
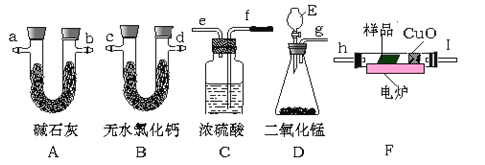
现准确称取1.8g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重1.76g,B管增重0.36g。请回答:
(1)用该方法可测定含有哪些元素和什么状态的有机物_________________;
(2)A、B管内均盛有固态试剂,B管的作用是__________________;
(3)产生的气体由左向右流向,所选用的各导管口连接的顺序是__________________。
(4)E中应盛装什么试剂:______________。
(5)如果把CuO网去掉,A管重量将_______;(填“增大”、“减小”、或“不变”)
(6)该有机物的最简式为__________________;
(7)要确定该有机物的分子式,还必须知道的数据是___________;
A.消耗液体E的质量
B.样品的摩尔质量
C.CuO固体减少的质量
D.C装置增加的质量
E.燃烧消耗O2的物质的量
(8)在整个实验开始之前,需先让D产生的气体通过整套装置一段时间,其目的是_______。
【答案】(1)含C、H或C、H、O元素的固态有机物;(2)吸收燃烧后产生的H2O(g);(3)g接f,e接h,I接c或(d),d或(c)接a或(b);(4)H2O2;(5)减小 ;(6)CHO2;(7)B;(8)赶出管内空气,减小实验误差。
【解析】试题分析:根据实验目的,连接顺序是g→f→e→h→I→c→d→a→d,(1)根据F装置,碱石灰测定CO2的质量,无水氯化钙测定H2O的质量,因此测定含C、H的的固态有机物,根据有机物的质量,可以确定有机物是否含氧,有:含C、H或C、H、O元素的固态有机物;(2)根据(1)的分析,B管的作用是吸收有机物燃烧产生的水蒸气;(3) )g接f,e接h,I接c或(d),d或(c)接a或(b);(4)有机物燃烧需要氧气,则D装置是产生氧气,利用的过氧化氢在MnO2催化剂作用下,分解产生氧气,分液漏斗中盛放H2O2;(5)CuO网可使有机物与氧气充分反应,如去掉CuO网,有机物不能充分反应,生成的CO2减少;(5)B管增重0.36g,则n(H2O) =" 0.36/18" = 0.02mol,A管增重0.88g,则n(CO2) =" 1.76/44mol" = 0.04mol,n(O) =" (1.8" - 0.04 - 0.04 × 12)/16 mol = 0.08mol,n(C):n(H):n(O) = 0.04:0.04:0.08 = 1:1:2,最简式为CHO2;(7)(CHO2)n = M,如果知道有机物的摩尔质量代入上式,求出分子式,故选项B;(8)空气中含有CO2和H2O,需通入一段时间的O2,减少实验误差。


科目:高中化学 来源: 题型:
【题目】 蚂蚁分泌的蚁酸主要成分是甲酸(结构式为![]() ,Ka=1.8×10-4),通常情况下是一种无色易挥发的液体。甲酸在浓硫酸作用下容易分解产生CO。某化学兴趣小组的同学对HCOOH的性质进行了以下探究:
,Ka=1.8×10-4),通常情况下是一种无色易挥发的液体。甲酸在浓硫酸作用下容易分解产生CO。某化学兴趣小组的同学对HCOOH的性质进行了以下探究:
I、该组同学选择如图1所示的装置探究HCOOH在浓硫酸作用下分解产生了CO,请完成下列各小题。
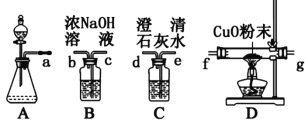

图1 图2
⑴写出甲酸分解的化学方程式 ;
⑵装置的连接顺序a ;
⑶HCOOH的分解产物中有CO的现象 ;
⑷该实验设计有一处明显的缺陷是 ;
II、该组同学分析了甲酸分子结构后,认为甲酸能发生银镜反应,并设计了如图2所示的实验。
⑸依图所示的实验,加热20分钟后并没有出现光亮的银镜。请解释实验中没有产生银镜的原因 ;
⑹请设计实验来验证你的解释 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将下列物质同时加入到水中,能大量共存且得到无色透明溶液的是
A. K2CO3 BaCl2 NaOH B. CaCl2 HCl KNO3
C. KOH KCl (NH4)2SO4 D. Fe2O3 HCl NaNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和联氨(N2H4)的性质及应用的研究是能源开发、环境保护的重要课题。
(1)①用CO、O2和KOH溶液可以制成碱性燃料电池,则该电池反应的离子方程式为 。
②用CO、O2和固体电解质还可以制成如下图1所示的燃料电池,则电极d的电极反应式为 。
(2)联氨的性质类似于氨气,将联氨通入CuO浊液中,有关物质的转化如图2所示。
①在图示2的转化中,化合价不变的元素是 (填元素名称)。
②在转化过程中通入氧气发生反应后,溶液的pH将 (填“增大”、“减小”或“不变”)。转化中当有1 mol N2H4参与反应时,需要消耗O2的物质的量为 。
③加入NaClO时发生的反应为:Cu(NH3)![]() +2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
+2ClO-+2OH-=Cu(OH)2↓+2N2H4↑+2Cl-+2H2O
该反应需在80℃以上进行,其目的除了加快反应速率外,还有 、 。
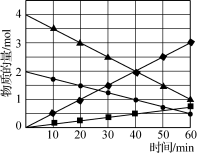
图3
(3)CO与SO2在铝矾土作催化剂、773 K条件下反应生成CO2和硫蒸气,该反应可用于从烟道气中回收硫,反应体系中各组分的物质的量与反应时间的关系如图3所示,写出该反应的化学方程式: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素X、Y、Z、W原子序数依次增大,X原子最外层电子数是其电子层数的3倍,Y与X可形成Y2X2和Y2X两种离子化合物,Z原子的核外电子数比Y原子多1,W与X同主族。下列说法正确的是( )
A.单质的还原性:Y>Z
B.原子半径:Y<Z<W
C.气态氢化物的稳定性:X<W
D.Y和Z两者最高价氧化物对应的水化物能相互反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究和开发CO2和CO的创新利用是环境保护和资源利用双赢的课题。
(1)CO可用于合成甲醇。在压强为0.1 MPa条件下,在体积为b L的密闭容器中充入a mol CO和2a mol H2,在催化剂作用下合成甲醇:CO(g)+2H2(g)![]() CH3OH(g)
CH3OH(g)
平衡时CO的转化率与温度、压强的关系如下图:

(ⅰ)该反应属于___________反应(填“吸热”或“放热”)。
(ⅱ)100 ℃时,若一个可逆反应的平衡常数K值很大,对此反应的说法正确的是___________(填序号)。
a.该反应使用催化剂意义不大
b.该反应发生将在很短的时间内完成
c.该反应达到平衡时至少有一种反应物百分含量很小
d.该反应一定是放热反应
(ⅲ)在温度和容积不变的情况下,再向平衡体系中充入a mol CO、2a mol H2,达到平衡时CO的转化率___________(填“增大”、“不变”或“减小”,下同),平衡常数___________。
(ⅳ)在某温度下,向一容积不变的密闭容器中充入2.5 mol CO、7.5 mol H2,反应生成CH3OH(g)达到平衡时,CO的转化率为90%,此时容器内压强为开始时压强的___________倍。
(2)某温度下,若将CO2(g)和H2(g)以体积比1∶4混合,在适当压强和催化剂作用下可制得甲烷,已知:
CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ·mol-1
H2(g)+1/2O2(g)===H2O(l) ΔH=-285.8 kJ·mol-1
则CO2(g)和H2(g)反应生成甲烷和液态水的热化学方程式为____________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com