
【题目】硫代硫酸钠(Na2S2O3)是一种重要的化工产品,易溶于水,遇酸易分解,Na2S2O3稀溶液与BaCl2溶液混合无沉淀生成。工业制备Na2S2O3的反应为: S(s)+Na2SO3(aq)![]() Na2S2O3(aq),产品中常含有少量Na2CO3 、 Na2SO3和Na2SO4。
Na2S2O3(aq),产品中常含有少量Na2CO3 、 Na2SO3和Na2SO4。
实验室拟用如下实验装置在C中制备Na2S2O3。

请回答下列问题:
(1)按如图所示装置进行实验,装置A中反应的化学方程式是______________________。装置C中可观察到溶液先变浑浊,后又澄清,生成的浑浊物质化学式为___________。
(2)装置B的作用为__________________;为保证Na2S2O3的产量,实验中通入的SO2不能过量,原因是_______________________________________________________。
(3)为了验证固体硫代硫酸钠工业产品中含有碳酸钠,选用下列装置进行实验:

①实验装置的连接顺序依次_________________(填装置的字母代号),装置C中的试剂为____________。
②能证明固体中含有碳酸钠的实验现象是__________________。
(4)若要检验固体硫代硫酸钠工业产品中含有Na2SO3,需先加水配成稀溶液,再依次加入的试剂为_____________________和品红溶液。
【答案】 Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑ S 防止溶液倒吸 若SO2过量,溶液显酸性,产物会分解 ADCB 品红溶液 装置C中品红溶液不褪色,B中澄清石灰水变浑浊 氯化钡溶液、盐酸
【解析】(1)A装置用亚硫酸钠与浓硫酸制备二氧化硫气体,发生的反应为Na2SO3+H2SO4(浓)=Na2SO4+H2O+SO2↑;C装置中二氧化硫与硫化钠反应:Na2S+H2O+SO2=Na2SO3+H2S,2H2S+SO2=3S↓+2H2O,S单质使溶液浑浊,S(s)+Na2SO3(aq)![]() Na2S2O3(aq),因此溶液澄清;(2)根据B装置的特点可判断B装置用来防止倒吸;由题可知,硫代硫酸钠遇酸易分解,SO2过量,溶液显酸性,产物分解;(3)①硫代硫酸钠遇酸易分解:S2O32-+2H+=H2O+SO2↑+S↓,若有碳酸钠:CO32-+2H+=H2O+CO2↑,A中应为酸溶液,需排除二氧化硫的干扰,二氧化硫有还原性,所以选用酸性高锰酸钾溶液除去,再用二氧化硫的漂白性,用品红溶液检验二氧化硫是否除净,最后再用澄清石灰水验证二氧化碳的生成;因此实验装置的连接顺序依次为ADCB;②根据以上分析可知证明固体中含有碳酸钠的实验现象是装置C中品红溶液不褪色,B中澄清石灰水变浑浊;(4)检验固体硫代硫酸钠工业产品中含有Na2SO3,需先加水配成稀溶液,Na2S2O3稀溶液与BaCl2溶液混合无沉淀生成,Na2SO3与BaCl2溶液混合有亚硫酸钡白色沉淀生成,故先用氯化钡溶液,再向沉淀中加稀盐酸,生成的气体用品红溶液检验即可。
Na2S2O3(aq),因此溶液澄清;(2)根据B装置的特点可判断B装置用来防止倒吸;由题可知,硫代硫酸钠遇酸易分解,SO2过量,溶液显酸性,产物分解;(3)①硫代硫酸钠遇酸易分解:S2O32-+2H+=H2O+SO2↑+S↓,若有碳酸钠:CO32-+2H+=H2O+CO2↑,A中应为酸溶液,需排除二氧化硫的干扰,二氧化硫有还原性,所以选用酸性高锰酸钾溶液除去,再用二氧化硫的漂白性,用品红溶液检验二氧化硫是否除净,最后再用澄清石灰水验证二氧化碳的生成;因此实验装置的连接顺序依次为ADCB;②根据以上分析可知证明固体中含有碳酸钠的实验现象是装置C中品红溶液不褪色,B中澄清石灰水变浑浊;(4)检验固体硫代硫酸钠工业产品中含有Na2SO3,需先加水配成稀溶液,Na2S2O3稀溶液与BaCl2溶液混合无沉淀生成,Na2SO3与BaCl2溶液混合有亚硫酸钡白色沉淀生成,故先用氯化钡溶液,再向沉淀中加稀盐酸,生成的气体用品红溶液检验即可。


科目:高中化学 来源: 题型:
【题目】钛、铁、镓、砷的单质及其化合物在生产生活中有重要的应用。回答下列问题;
(1)写出As的基态原子的电子排布式_________________________。
(2)N、P、As为同一主族元素,其电负性由大到小的顺序为_________________________,它们的氢化物沸点最高的是___________,原因为____________________________。
(3)Fe3+、Co3+与N3-、CN-等可形成络合离子。
①K3[Fe(CN)6]可用于检验Fe2+,配体CN-中碳原子杂化轨道类型为_________________。
②[Co(N3) (NH3)5]SO4中Co的配位数为________________,其配离子中含有的化学键类型为______(填离子键、共价键、配位键),C、N、O的第一电离能最大的为_______________,其原因是__________________________。
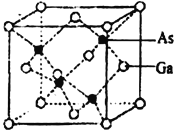
(4)砷化镓晶胞结构如下图。晶胞中Ga与周围等距且最近的As形成的空间构型为_____________。已知砷化镓晶胞边长为apm,其密度为ρg·cm-3,则阿伏加德罗常数的数值为_______(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A. 将2 mol NO和2 mol O2混合,充分反应后体系中原子总数为8NA
B. 将100 mL 0.1 mol·L﹣1的FeCl3溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA
C. CO2通过Na2O2使其增重a g时,反应中转移的电子数为![]() NA
NA
D. 100 g质量分数为9.8%的H2SO4水溶液中含氧原子数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关一些有机物的相关叙述正确的是:
A. 苯滴入溴水中因发生取代反应而使溴水褪色
B. 乙酸和乙醇都能使紫色石蕊试液变红
C. 所有的有机物都易溶于有机溶剂而不溶于水
D. 乙烯通入到溴水中因发生加成反应而使溴水褪色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 24 g 镁与27 g铝中,含有相同的质子数
B. 同等质量的氧气和臭氧中,电子数相同
C. 1 mol重水与1 mol水中,中子数比为2∶1
D. 1 mol乙烷和1 mol乙烯中,化学键数相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用惰性电极电解硫酸铜溶液,整个过程转移电子的物质的量与产生气体总体积的关系如图所示(气体体积均在相同状况下测定)。欲使溶液恢复到起始状态,可向溶液中加入
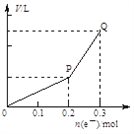
A. 0.1 mol CuO B. 0.05 mol Cu2(OH)2CO3
C. 0.1 mol Cu(OH)2 D. 0.1 mol CuCO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,Ka1(H2C2O4)=10-1.3, Ka2(H2C2O4)=10-4.2。用0.1000 mol·L-1 NaOH溶液滴定10.00 mL 0.1000 mol·L-1 H2C2O4溶液所得滴定曲线如右图。下列说法正确的是

A. 点①所示溶液中:c(Na+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
B. 点②所示溶液中:c(HC2O4-)=c(C2O42-)
C. 点③所示溶液中:c(Na+)=c(HC2O4-) + c(C2O42-)
D. 点④所示溶液中:c(Na+) + 2c(H2C2O4) + 2c(H+)=2c(OH-) + 2c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】0.10mol/L HA(Ka=10-9.89)溶液,调节溶液pH后。保持[HA] + [A-]=0.10mol/L。下列关系正确的是
A. pH=2.00时,[HA] > [H+]> [OH-] > [A-]
B. pH=7.00时,[HA] = [A-] > [OH-]= [H+]
C. pH=9.89时,[HA] = [A-] > [OH-]> [H+]
D. pH=14.00时,[OH-]>[A-]>[H+]>[HA]
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com