
【题目】在对电子运动状态的描述中,确定一个“轨道”应选择以下四项中的( )
①能层②能级③电子云的伸展方向④电子的自旋状态
A.①②③④B.①②③C.①②D.①
科目:高中化学 来源: 题型:
【题目】一种石墨烯锂硫电池(2Li+S8=Li2S8)工作原理示意如图。下列有关该电池说法正确的是

A. B电极发生还原反应
B. A电极上发生的一个电极反应为:2Li++S8+2e-=Li2S8
C. 每生成1mol Li2S8转移0.25mol电子
D. 电子从B电极经过外电路流向A电极,再经过电解质流回B电极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验探究:探究碳、硅元素的非金属性的相对强弱。根据要求完成 下列各小题。
(1)实验装置:
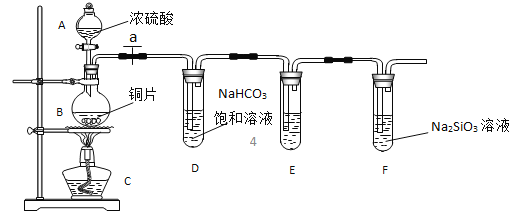
填写所示仪器名称 A_________B________________________
(2)实验步骤:
连接仪器、_____________、加药品后,打开 a、然后滴入浓硫酸,加热
(3)问题探究:(已知酸性强弱:亚硫酸 >碳酸)
①铜与浓硫酸反应的化学方程式是________________________________;装置E中足量酸性KMnO4溶液的作用是_____________________________;
②能说明碳元素的非金属性比硅元素非金属性强的实验现象是____________________________;
③依据试管 D 中的实验现象,能否证明硫元素的非金属性强于碳元素的非金属性___(填 “能”或“否”),试管 D 中发生反应的离子方程式是______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】亚硝酸钠(NaNO2)可将人体血红蛋白中的Fe2+氧化成Fe3+生成高铁血红蛋白而丧失与O2结合的能力。误食NaNO2中毒可用维生素C缓解。下列叙述中表现NaNO2和维生素C的性质的是( )
A.还原性和氧化性 B.氧化性和还原性
C.氧化性和酸性 D.还原性和碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电化学原理在防止金属腐蚀、能量转换、物质合成等方面应用广泛。

(1)图1中,为了减缓海水对钢闸门A的腐蚀,材料B可以选择__________(填字母序号)
a.碳棒 b.锌板 c.铜板
用电化学原理解释材料B需定期拆换的原因_______________。

(2)镁燃料电池在可移动电子设备电源和备用电源等方面应用前景广阔。图2为“镁—次氯酸盐”燃料电池原理示意图,电极为镁合金和铂合金。
①E为该燃料电池的_____________极(填“正”或“负”)。F电极上的电极反应式为_____________。
②镁燃料电池负极容易发生自腐蚀产生氢气,使负极利用率降低,用化学用语解释其原因____________。
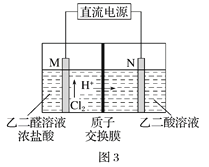
(3)乙醛酸(HOOC-CHO)是有机合成的重要中间体。工业上用“双极室成对电解法”生产乙醛酸,原理如图3所示,该装置中阴、阳两极为惰性电极,两级室均可产生乙醛酸,其中乙二醛与M电极的产物反应生成乙醛酸。
①N电极上的电极反应式为______________。
②若有2molH+通过质子交换膜,并完全参与了反应,则该装置中生成的乙醛酸为________________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
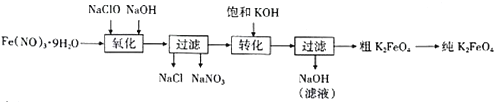
【题目】高铁酸钾(K2FeO4)是铁的一种重要化合物,是一种新型、高效、多功能水处理剂。一种湿法制备高铁酸钾的工艺流程如下图所示:
已知高铁酸钾的部分性质如下:
① 热稳定性差,溶液的pH对其稳定性的影响也很大;即在低温、碱性环境中稳定,高温、中性和酸性条件下不稳定。
② 在水中溶解度大,难溶于无水乙醇等有机溶剂。
③ 具有强氧化性,能氧化烃、80%以下的乙醇溶液等物质。
回答下列问题:
(1)该生产工艺应在温度_____(填“较高”或“较低”)的情况下进行。
(2)上述氧化过程中,发生反应的离了方程式为_______。
(3)由流程图可见,湿法制备高铁酸钾时,需先制得高铁酸钠,然后再向高铁酸钠中加入饱和KOH溶液,即可析出高铁酸钾
① 加入饱和KOH溶液的目的是:______。
② 由以上信息可知:Ksp(K2FeO4)______Ksp(Na2FeO4)(填“大于”或“小于”)。
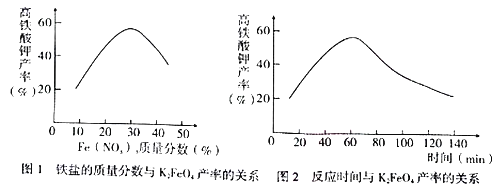
(4)实验测得铁盐溶液的质量分数、反应时间与K2FeO4产率的实验数据分别如下图l、图2所示。为了获取更多的高铁酸钾,铁盐的质量分数应控制在______附近、反应时间应控制在______。
(5)粗K2FeO4→纯K2FeO4包括重结晶、过滤、洗涤、干燥几个步骤。洗涤、干燥的目的是脱碱、脱水,洗涤时最好用______洗涤。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向20mL0.5mol L-1的醋酸溶液中逐滴加入等物质的量浓度的烧碱溶液,测定混合溶液的温度变化如图所示。下列关于混合溶液的相关说法中错误的是

A. 由水电离出的c(H+):C点>B点
B. 醋酸的电离平衡常数:B点> A点
C. 从A点到B点,混合溶液中可能存在:c( CH3COO-) = c(Na+)
D. C 点混合溶液中一定存在:c(Na+) =2c(CH3COO-) +2c(CH3COOH)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com