
【题目】下列说法正确的是( )
A.放热反应均是自发反应
B.△S为正值的反应均是自发反应
C.物质的量增加的反应,△S为正值
D.如果△H和△S均为正值,当温度升高时,反应可能自发进行
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某化学兴趣小组设计实验探究反应速率的测定和比较。
【实验目的】测定锌与稀硫酸反应的速率
【实验用品】锥形瓶、双孔塞、胶皮管、分液漏斗、直角导管、50mL注射器、铁架台、秒表、锌粒、1 mol/L硫酸、4 mol/L硫酸。
【实验步骤】
(1)取一套装置(如图所示),加入40 mL 1 mol/L的硫酸和锌粒,测量收集10 mL H2所需的时间。
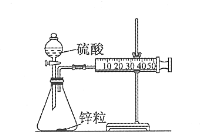
(2)取另一套装置,加入40 mL4 mol/L的硫酸和锌粒,测量收集10 mL H2所需的时间。
【实验现象】锌与稀硫酸反应 (写现象),收集10mL气体,(2)所用时间比(1)所用时间_________。
【实验结果】
加入试剂 | 反应时间 | 反应速率 |
40 mL 1 mol/L硫酸 | 长 | _________ |
40 mL 4 mol/L硫酸 | 短 | _________ |
【实验结论】4 mol/L硫酸与锌反应比1 mol/L硫酸与锌反应的速率 。
【注意事项】(1)锌的颗粒(即表面积)大小 ;
(2)40 mL的硫酸要迅速加入;
(3)装置 ,且计时要迅速准确;
(4)气体收集可以用排水量气装置(如图所示)代替。
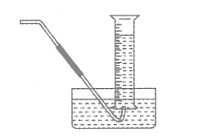
【实验讨论】除本实验测定反应速率的方法外,可行的方案还有(至少填两种):
(1) 。
(2) 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化合物由碳、氢两种元素组成,其中含碳的质量分数为85.7%,在标准状况下11.2L此化合物的质量为14g,求此化合物的分子式_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】ClO2在常温下是一种黄绿色有刺激性气味的气体,熔点:﹣59℃,沸点:11.0℃,易溶于水.工业上用稍潮湿的KClO3 , 和草酸(H2C2O4)在60℃时反应制得,某学生拟用图1所示装置模拟工业制取并收集ClO2 . 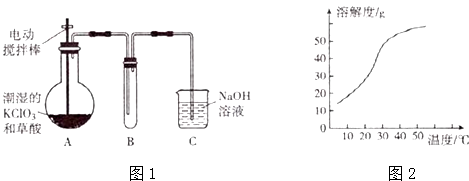
(1)A装罝必须添加温度控制装置,除酒精灯外,还要的玻璃仪器有烧杯、
(2)B装置必须放在冰水浴中,其原因是 .
(3)反应后在装置C中可得NaClO2溶液.已知:(1)NaClO2饱和溶液在温度低于38℃时析出的晶体是NaClO23H2O,在温度高于38℃时析出的晶体是NaClO2 , 在温度髙于60℃时NaClO2 , 分解生成NaClO3和NaCl.(2)NaClO2的溶解度曲线如图2所示.请补充从NaClO2溶液中制得NaClO2晶体的操作步骤:
①减压,55℃蒸发结晶;②;③洗涤;④;得到成品.
(4)已知在酸性条件下NaClO2可发生反应生成NaCl并释放出ClO2 , 该反应的离子方程式为
(5))用ClO2处理过的饮用水会含有一定量的亚氯酸盐.若要除去超标的亚氯酸盐,下列物质最适宜的是(填序号).
A.明矾
B.碘化钾
C.盐酸
D.硫酸亚铁
(6)利用ClO2氧化氮氧化物的反应过程如下:
NO ![]() NO2
NO2 ![]() 无污染气体
无污染气体
反应Ⅰ的化学方程式为2NO+ClO2+H2O═NO2+HNO3+HCl,反应Ⅱ的离子方程式为
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学设计如图1所示装置分别进行探究实验(夹持装置已略去),请回答下列问题:
实验 | 药品 | 制取气体 | 量气管中的液体 |
Ⅰ | Cu、稀HNO3 | H2O | |
Ⅱ | NaOH固体、浓氨水 | NH3 | |
Ⅲ | Na2SO3固体、浓H2SO4 | SO2 | |
Ⅳ | 镁铝合金、NaOH溶液(足量) | H2 | H2O |
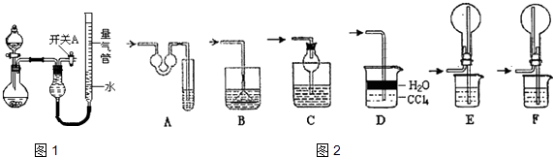
(1)实验过程中,使用分液漏斗滴加液体的操作是 .
(2)该同学认为实验I可通过收集并测量NO气体的体积来探究铜样品的纯度,你认为是否可行?(填“可行”或“不可行”).原因为
(3)实验Ⅲ烧瓶中产生的SO2气体通入溴水溶液中发生反应的离子方程式是 .
(4)实验Ⅱ中量气管中的液体最好是(填字母编号,下同).
a.浓NaOH溶液 b.氨水 c.煤油 d.氯化铵溶液
该实验剩余的NH3需吸收处理.如图2,以下各种尾气吸收装置中,适合于吸收NH3 , 而且能防止倒吸的有 .
(5)本实验应对量气管多次读数,读数时应注意:①将实验装置恢复到室温,② , ③视线与凹液面最低处相平.
(6)实验Ⅳ获得以下数据(所有气体体积已换算成标准状况,忽略滴入液体体积对气体体积的影响)
编号 | 镁铝合金度量 | 量气管第一次读数 | 量气管第二次读数 |
① | 1.0g | 10.0mL | 346.3mL |
② | 1.0g | 10.0mL | 335.0mL |
③ | 1.0g | 10.0mL | 345.7mL |
根据上述数据,可计算出镁铝合金中铝的质量分数为 . (H:1 Mg:24 Al:27)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三氧化铀是一种两性氧化物,它在溶液中可以以UO22+和U2O72-形式存在,按要求写出UO3与强酸、强碱反应的离子方程式:
(1)______________________________;(2)_________________________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A. NH3、CO、CO2都是极性分子
B. CH4、CCl4都是含有极性键的非极性分子
C. HF、HCl、HBr、HI的稳定性依次增强
D. CS2、H2O、C2H2都是直线形分子
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com