
氧化还原反应中实际上包含氧化和还原两个过程,下面是一个还原过程的反应式:NO3-+4H++3e-=NO+2H2O,KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种物质(甲)能使上述还原过程发生。
(1)写出并配平该氧化还原反应的化学方程式:________________________。
(2)反应中硝酸体现了________、________的性质。
(3)反应中若产生0.2 mol气体,则转移电子的物质的量是________mol。
(4)若1 mol甲与某浓度硝酸反应时,被还原硝酸的物质的量增加,原因是_________________________________________________________________。
科目:高中化学 来源: 题型:填空题
(14分)Na、Cu、O、Si、S、Cl是常见的六种元素。
(1)Na位于元素周期表第 周期第 族;S的基态原子核外有 个未成对电子;Si的基态原子核外电子排布式为 。
(2)用“>”或“<”填空:
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| Si S | O2- Na+ | NaCl Si | H2SO4 HClO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
取一定量的酸性KMnO4溶液依次进行下列实验,有关现象记录如下:
①滴加适量H2O2,紫红色褪去,并有气泡产生;
②再加入适量的PbO2固体,固体溶解,溶液又变为紫红色;
③最后通入足量的SO2气体。
请回答下列问题:
(1)KMnO4、H2O2、PbO2氧化性由强到弱的顺序为 ;
(2)实验③中的现象为 。
(3)实验①、②中反应的离子方程式分别是 、 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
六种短周期元素,aA、bB、cC、dD、eE、fF,已知原子序数大小关系是:a<e<c<b<f<d,且a+b=(c+d)/2;六种元素在周期表中的位置关系是:A、B同主族,C、D也同主族;C、E相邻,B、F也相邻。
(1)B、C、D三种元素形成的六原子核的化合物和水反应的离子方程式是: 。
(2)A、C形成的四原子核化合物甲的电子式为 ,该化合物呈弱酸性,试写出这种化合物的电离方程式: 。
(3)写出分别由A、B、C、D四种元素所形成的两种化合物的水溶液相互反应的离子方程式: 。
(4)写出A、C、D形成的六原子核化合物乙的水溶液和甲的水溶液反应的化学方程式: 。
(5)写出E和F形成的化合物和化合物A2C反应的化学方程式: 。
(6)A、E形成的四原子核化合物丙容易液化,其原因是: 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某校学生化学实验小组,为验证非金属元素氯的氧化性强于硫和氮,设计了一套实验装置(部分夹持装置已略去):
(1)写出A中反应的离子方程式 。
(2)B中出现黄色浑浊现象,产生此现象的离子方程式 。
(3)D中干燥管中出现的现象是 ,化学方程式 。
(4)有同学认为D中的现象并不能说明氯的氧化性大于氮,需要在C之前加装洗气装置,请指出洗气装置盛装试剂 。
(5)还有什么方法能证明氧化性Cl2>S ,用一种相关事实说明 。
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
食盐中含有一定量的镁、铁等杂质,加碘盐中碘的损失主要是由于杂质、水分、空气中的氧气以及光照、受热而引起的。已知:
氧化性:IO3->Fe3+>I2;还原性:S2O32->I-
3I2+6OH-=5I-+IO3-+3H2O
KI+I2 KI3
KI3
(1)某学习小组对加碘盐进行了如下实验:取一定量某加碘盐(可能含有KIO3、KI、Mg2+、Fe3+),用适量蒸馏水溶解,并加稀盐酸酸化,将所得试液分为3份。第一份试液中滴加KSCN溶液后显红色;第二份试液中加足量KI固体,溶液显淡黄色,用CCl4萃取,下层溶液显紫红色;第三份试液中加入适量KIO3固体后,滴加淀粉试剂,溶液不变色。
①加KSCN溶液显红色,该红色物质是 (用化学式表示);CCl4中显紫红色的物质是 (用电子式表示)。
②第二份试液中加入足量KI固体后,反应的离子方程式为 、 。
(2)KI作为加碘剂的食盐在保存过程中,由于空气中氧气的作用,容易引起碘的损失。写出潮湿环境中KI与氧气反应的化学方程式: 。
将I2溶于KI溶液,在低温条件下,可制得KI3·H2O。该物质作为食盐加碘剂是否合适? (填“是”或“否”),并说明理由: 。
(3)为了提高加碘盐(添加KI)的稳定性,可加稳定剂减少碘的损失。下列物质中有可能作为稳定剂的是 。
| A.Na2S2O3 | B.AlCl3 |
| C.Na2CO3 | D.NaNO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
由几种离子化合物组成的混合物,含有以下离子中的若干种:K+、NH、Ba2+、Al3+、Fe3+、Cl-、SO42-、CO32-,将该混合物溶于水后得澄清溶液,现取3份100 mL该溶液分别进行如下实验:
| 序号 | 实验内容 | 实验结果 |
| 1 | 加过量盐酸 | 无气体产生 |
| 2 | 加足量NaOH溶液并加热 | 收集到气体1.12 L(已折算成标准状况下的体积),并有红褐色沉淀生成,将沉淀过滤洗涤、干燥、灼烧,称重得1.60 g固体。 |
| 3 | 加足量BaCl2溶液时,对所得沉淀进行洗涤、干燥、称量 | 第一次称量读数为2.33 g |
| 阴离子符号 | 物质的量浓度(mol·L-1) |
| | |
| | |
| | |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
某工业废水仅含下表中的某些离子,且各种离子的物质的量浓度相等,均为0.1 mol/L(此数值忽略水的电离及离子的水解)。
| 阳离子 | K+ Ag+ Mg2+ Cu2+ Al3+ NH4+ |
| 阴离子 | Cl- CO32— NO3— SO42— I- |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
(9分)生产生活中广泛涉及氧化还原反应。
(1)工业上冶炼下列物质通常不采用电解法的是 。
a.Na b.Mg c.Fe d.Ag
(2)下图为电解精炼铜的示意图,电极a为粗铜,则a连接电源的 极,b极的电极反应式为 。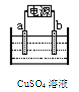
(3)汽车剧烈碰撞时,安全气囊中发生反应NaN3 + KNO3 → K2O + Na2O + X↑(未配平),已知X为单质,在反应中NaN3失去电子。则该反应的氧化剂为 ,X的化学式为 ,该反应的氧化剂和还原剂的物质的量之比为 。
(4)工业上制取高纯度MnO2的某一步骤如图所示,请写出该反应的离子方程式 。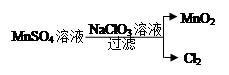
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com