
| A. | 用氢氟酸来刻蚀玻璃:SiO2+4H++4F-═SiF4↑+2H2O | |
| B. | 用石墨电极电解AlCl3溶液:2Al3++6H2O═2Al(OH)3↓+3H2↑ | |
| C. | 铅蓄电池放电时的反应:Pb+PbSO4+4H++SO42-═2Pb2++SO42-+2H2O | |
| D. | 酸性高锰酸钾溶液与草酸反应:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O |
分析 A.HF在离子反应中保留化学式;
B.生成氢气、氯气、氢氧化铝;
C.放电时Pb失去电子生成硫酸铅;
D.发生氧化还原反应,遵循电子、电荷守恒.
解答 解:A.用氢氟酸来刻蚀玻璃的离子反应为SiO2+4HF═SiF4↑+2H2O,故A错误;
B.用石墨电极电解AlCl3溶液6Cl-+2Al3++6H2O$\frac{\underline{\;电解\;}}{\;}$2Al(OH)3↓+3H2↑+3Cl2↑,故B错误;
C.铅蓄电池放电时的反应:Pb-2e-+SO42-═PbSO4,故C错误;
D.酸性高锰酸钾溶液与草酸反应的离子反应为2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O,故D正确;
故选D.
点评 本题考查离子反应方程式的书写,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重氧化还原反应、复分解反应的离子反应考查,注意离子反应中保留化学式的物质及电子、电荷守恒,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 5.6 g铁与足量稀硝酸反应,转移电子的数目为0.2 NA | |
| B. | 标准状况下,22.4 L二氯甲烷的分子数约为NA | |
| C. | 8.8g乙酸乙酯中含共用电子对数为1.4 NA | |
| D. | 1 L 0.1 mol•L-1氯化铜溶液中铜离子数为0.1 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
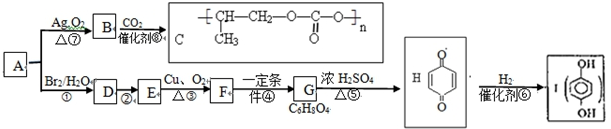
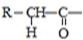 $\stackrel{一定条件下}{→}$
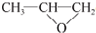
$\stackrel{一定条件下}{→}$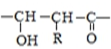
 ;⑤的反应类型是消去反应.
;⑤的反应类型是消去反应.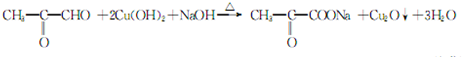 ;
;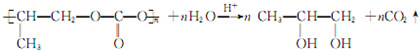 .
.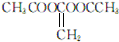 或
或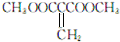 )(任写两种)
)(任写两种)查看答案和解析>>
科目:高中化学 来源: 题型:填空题
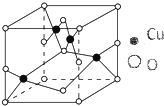 纯铜在工业上主要用来制造导线、电器元件等,铜能形成多种-1和+2价态的化合物且其化合物常带有颜色.
纯铜在工业上主要用来制造导线、电器元件等,铜能形成多种-1和+2价态的化合物且其化合物常带有颜色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol/LNaHCO3 溶液中有:c(Na+)>c(HCO3-)+c(CO32-)+c(OH-) | |
| B. | 在NaHSO4溶液中有:c(Na+)=c(SO42-)=c(H+) | |
| C. | 在新制氯水中加入KOH至溶液呈中性,则溶液中有:c(K+)=2c(ClO-)+C(HClO) | |
| D. | 将等物质的量浓度的Na2SO3溶液和NaHSO4溶液等体积混合后的混合溶液中:c(OH-)-c(H2SO3)=c(H+)+c(SO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
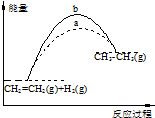
| A. | 图1中a、b曲线可分别表示反应CH2═CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时反应过程中的能量变化 | |
| B. | 己知2C(s)+2O2(g)═2CO2(g)△H1 ,2C(s)+O2(g)═2CO(g)△H2则△H1>△H2 | |
| C. | 同温同压下,反应H2(g)+Cl2(g)═2HCl(g)在光照和点燃条件下的△H相同 | |
| D. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.4 kJ•mo1-1,20g氢氧化钠固体溶于稀盐酸中恰好完全反应时放出的热量等于28.7kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3 | B. | SiO2 | C. | Fe2O3 | D. | MgO |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Zn与稀硫酸反应制取H2时,加入蒸馏水 | |
| B. | Al在O2中燃烧生成Al2O3时,用铝粉替代铝片 | |
| C. | CaCO3与稀盐酸反应生成CO2时,适当升高温度 | |
| D. | 用KClO3固体分解制取O2时,固体中添加少量MnO2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com