
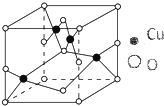
 纯铜在工业上主要用来制造导线、电器元件等,铜能形成多种-1和+2价态的化合物且其化合物常带有颜色.
纯铜在工业上主要用来制造导线、电器元件等,铜能形成多种-1和+2价态的化合物且其化合物常带有颜色.分析 (1)Cu原子核外电子数为29,根据能量最低原理书写核外电子排布式,价电子排布为3d104s1;
(2)根据晶胞示意图利用均摊法进行计算晶胞中含有的两种元素的离子个数;
(3)①根据价层电子对互斥理论确定S原子的杂化方式;
②NH3分子中孤对电子数为1,成键数为3,与NH3分子互为等电子体的一种微粒具有相同的价电子数和原子数;
(4)由于NH3分子之间存在氢键,所以NH3的沸点高于PH3;
(5)离子化合物中,离子半径越小,离子键越强,晶格能大,熔点越高.
解答 解:(1)Cu原子核外电子数为29,根据能量最低原理,其核外电子排布式为:1s22s22p63s23p63d104s1,价电子排布为3d104s1,则基态Cu+的核外电子排布式为[Ar]3d10,
故答案为:[Ar]3d10;
(2)由晶胞示意图可知,1个晶胞中有4个铜,氧为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4个,原子个数之比为1:1,该氧化物的化学式为CuO,
故答案为:CuO;
(3)①SO42-中S原子的价层电子数=4+$\frac{1}{2}$(6+2-4×2)=4,所以采取杂sp3化方式,
故答案为:sp3;
②与NH3分子互为等电子体的一种微粒具有相同的价电子数8和原子数4,微粒为PH3或H3O+等,
故答案为:H3O+;
(4)由于NH3分子之间存在氢键,所以NH3的沸点高于PH3,
故答案为:NH3分子间能够形成氢键;
(5)离子化合物中,离子半径越小,离子键越强,熔点越高,离子半径O2-<Cl-,CuO阴阳离子所带电荷大于CuCl阴阳离子所带电荷,CuO中晶格能大,则CuO的熔点比CuCl的熔点高,
故答案为:高;CuO的阴阳离子半径小于CuCl的离子半径,CuO阴阳离子所带电荷大于CuCl阴阳离子所带电荷,CuO中晶格能大.
点评 本题考查了价电子排布、晶体结构、原子杂化方式、离子晶体的熔点大小比较等知识,有一定的综合性,题目中等难度,注意基础知识的运用.


 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
名题训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 平衡向逆反应方向转动 | B. | 平衡不移动 | ||
| C. | C的百分含量增大 | D. | C的百分含量减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
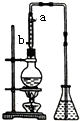 市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\underset{\stackrel{{H}^{+}}{→}}{\;}$n(C2H4O).
市售乙醛通常为40%左右的乙醛溶液.久置的乙醛溶液会产生分层现象,上层为无色油状液体,下层为水溶液.据测定,上层物质为乙醛的加合物(C2H4O)n,它的沸点比水的沸点高,分子中无醛基.乙醛在溶液中易被氧化,为从变质的乙醛溶液中提取乙醛(仍得到溶液),可利用如下反应原理:(C2H4O)n$\underset{\stackrel{{H}^{+}}{→}}{\;}$n(C2H4O).查看答案和解析>>
科目:高中化学 来源: 题型:实验题
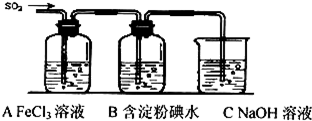
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蔬菜表面洒少许福尔马林,可保鲜和消毒 | |
| B. | 推广使用可降解塑料及布质购物袋,以减少“白色污染” | |
| C. | 绿色食品就是不使用化肥农药,不含任何化学物质的食品 | |
| D. | 推广使用煤液化技术可减少二氧化碳温室气体的排放 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. |  制取并收集少量HCl | B. | 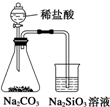 证明非金属性强弱:Cl>C>Si | ||
| C. | 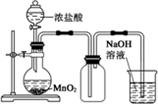 实验室制Cl2 | D. | 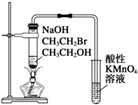 验证溴乙烷发生消去反应生成烯烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用氢氟酸来刻蚀玻璃:SiO2+4H++4F-═SiF4↑+2H2O | |
| B. | 用石墨电极电解AlCl3溶液:2Al3++6H2O═2Al(OH)3↓+3H2↑ | |
| C. | 铅蓄电池放电时的反应:Pb+PbSO4+4H++SO42-═2Pb2++SO42-+2H2O | |
| D. | 酸性高锰酸钾溶液与草酸反应:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 导电性 | B. | 水溶性 | C. | 氧化性 | D. | 化学稳定性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
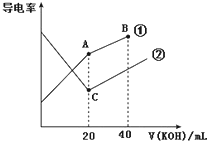
| A. | A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)═0.1mol•L-1 | |
| B. | B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+) | |
| C. | C点水电离的c(OH-)大于A点水电离的c(OH-) | |
| D. | A、B、C三点溶液均有Kw=c(H+)•c(OH-)=1.0×10-14 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com