
| A. | 蔬菜表面洒少许福尔马林,可保鲜和消毒 | |
| B. | 推广使用可降解塑料及布质购物袋,以减少“白色污染” | |
| C. | 绿色食品就是不使用化肥农药,不含任何化学物质的食品 | |
| D. | 推广使用煤液化技术可减少二氧化碳温室气体的排放 |
分析 A.HClO的水溶液为福尔马林,HClO有毒;
B.塑料不能降解,导致白色污染;
C.绿色食品是指在无污染的条件下种植、养殖、施有机肥料、不用高毒性、高残留农药、在标准环境、生产技术、卫生标准下加工生产、经权威机构认定并使用专门标志的安全、优质、营养类食品的统称;
D.煤液化转化为甲醇,减少污染物的排放,提高能源利用率.
解答 解:A.HClO的水溶液为福尔马林,HClO有毒,则不能对蔬菜保鲜和消毒,故A错误;
B.塑料不能降解,导致白色污染,则推广使用可降解塑料及布质购物袋,以减少“白色污染”,故B正确;
C.绿色食品是指在无污染的条件下种植、养殖、施有机肥料、不用高毒性、高残留农药、在标准环境的食品,生产时可以使用有机化肥和低毒的农药,故C错误;
D.煤液化转化为甲醇,减少污染物的排放,提高能源利用率,则推广使用煤液化技术可减少二氧化硫及固体颗粒污染物排放,不能减少二氧化碳气体排放,故D错误;
故选B.
点评 本题考查环境保护及绿色化学,为高频考点,把握物质的性质、化学与生活的联系、环境保护等为解答的关键,侧重分析与应用能力的考查,题目难度不大.


 赢在课堂名师课时计划系列答案
赢在课堂名师课时计划系列答案 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案科目:高中化学 来源: 题型:实验题
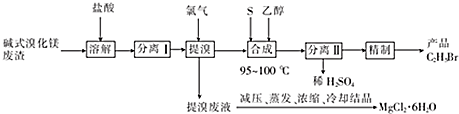
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
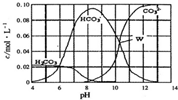 25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1L 的溶液,溶液中部分微粒与pH的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )
25℃时,0.1 mol Na2CO3与盐酸混合所得的一组体积为1L 的溶液,溶液中部分微粒与pH的关系如图所示.下列有关溶液中离子浓度关系叙述正确的是( )| A. | W点所示的溶液中:c(Na+)+c(H+)=4c(CO32-)+c(OH-)+c(Cl-) | |
| B. | pH=4的溶液中:c(H2CO3)+c(HCO3-)+c(CO32-)=0.1 mol/L | |
| C. | pH=8的溶液中:c(H+)+2c(H2CO3)+c(HCO3-)=c(OH-)+c(Cl-) | |
| D. | pH=11的溶液中:c(Na+)>c(Cl-)>c(CO32-)>c(HCO3-)>c(H2CO3) |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
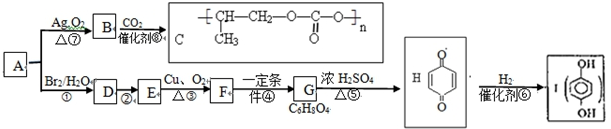
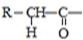 $\stackrel{一定条件下}{→}$
$\stackrel{一定条件下}{→}$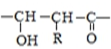
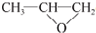 ;⑤的反应类型是消去反应.
;⑤的反应类型是消去反应.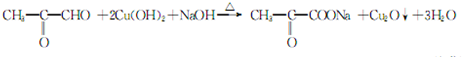 ;
;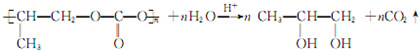 .
.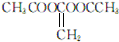 或
或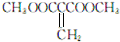 )(任写两种)
)(任写两种)查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在中和热的测定实验中,将氢氧化钠溶液迅速倒入盛有盐酸的量热计中,立即盖上盖板,用环形玻璃搅拌棒不断搅拌,准确读出反应体系的最高温度 | |
| B. | 实验事实证明乙酸乙酯中少量乙醇可以用水洗方法除去,其原理与溴水中加四氯化碳萃取溴类似 | |
| C. | 油脂制肥皂实验中加乙醇的目的是增大油脂的溶解度,加快油脂皂化反应速率 | |
| D. | 当高锰酸钾晶体结块时,应在研钵中用力研磨,以得到细小晶体,有利于加快反应或溶解的速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
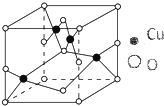 纯铜在工业上主要用来制造导线、电器元件等,铜能形成多种-1和+2价态的化合物且其化合物常带有颜色.
纯铜在工业上主要用来制造导线、电器元件等,铜能形成多种-1和+2价态的化合物且其化合物常带有颜色.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在0.1mol/LNaHCO3 溶液中有:c(Na+)>c(HCO3-)+c(CO32-)+c(OH-) | |
| B. | 在NaHSO4溶液中有:c(Na+)=c(SO42-)=c(H+) | |
| C. | 在新制氯水中加入KOH至溶液呈中性,则溶液中有:c(K+)=2c(ClO-)+C(HClO) | |
| D. | 将等物质的量浓度的Na2SO3溶液和NaHSO4溶液等体积混合后的混合溶液中:c(OH-)-c(H2SO3)=c(H+)+c(SO32-) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Al2O3 | B. | SiO2 | C. | Fe2O3 | D. | MgO |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
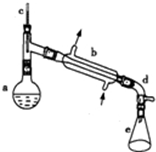 醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图所示.可能用到的有关数据如下:
醇脱水是合成烯烃的常用方法,实验室合成环己烯的反应和实验装置如图所示.可能用到的有关数据如下:| 相对分子质量 | 密度/(g•cm-3) | 沸点/℃ | 溶解性 | |
| 环乙醇 | 100 | 0.9618 | 161 | 微溶于水 |
| 环己烯 | 82 | 0.8102 | 83 | 难溶于水 |
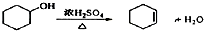 ;
;查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com