
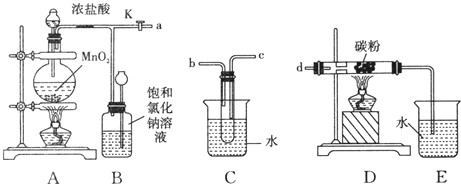
分析 (1)分析装置D中反应,反应物有C、Cl2,生成物有CO2、HCl,显然反应物中缺少O、H两种元素,C的作用的提供水蒸气,连接方式应选择能让Cl2带走更多水蒸气的方式,气体通过盛有水的试管时应长进短出;
(2)根据反应物和生成物,结合质量守恒定律书写化学方程式;利用浓硫酸溶于水放热的性质分析;
(3)关闭旋塞K,B中的气体逐渐增多,压强增大,B能贮存气体;
(4)CCl4密度大于水,氯气和水反应生成次氯酸具有漂白性;
(5)HCl极易溶于水,易产生倒吸现象.
解答 解:(1)由装置图判断判断,气体由B流经C进入到D中反应,气体通过盛有水的试管时应长进短出,否则不能通过C装置,故答案为:c,b;
(2)由题意知反应为Cl2、C、H2O,生成物为HCl和CO2,则反应的化学方程式为2Cl2+C+2H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$4HCl+CO2,C为提供水蒸气的装置,加入的浓硫酸溶于水放出大量的热,有利于试管中的水变为水蒸气,
故答案为:2Cl2+C+2H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$4HCl+CO2;加入的浓硫酸溶于水放出大量的热,有利于试管中的水变为水蒸气,从而提供足量的水蒸气供D中反应需要;
(3)关闭旋塞K,移去两个酒精灯,由于余热的作用,A处仍有少量Cl2产生,B中的气体逐渐增多,压强增大,则导致瓶中液面下降,长颈漏斗内液面上升,氯气有毒,不能直接排放到空气中,B具有贮存少量氯气,并能防止空气污染,
故答案为:瓶中液面下降,长颈漏斗内液面上升;贮存少量Cl2,避免Cl2对环境造成污染;
(4)用量筒量取20 mL E中溶液,倒入已检查完气密性良好的分液漏斗中,然后再注入10 mL CCl4,盖好玻璃塞,振荡,静置于铁架台上,等分层后取上层液和下层液,四氯化碳比水重,氯气在四氯化碳中的溶解性大于水中,所以呈黄绿色的是下层液,上层也中含有氯气和水反应生成的次氯酸具有漂白性,能使有色布条褪色,
故答案为:下层液,上层液;
(5)HCl极易溶于水,易产生倒吸现象,应用倒置的漏斗,
答:D中反应生成的HCl气体极易溶于水,易发生倒吸,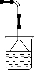 ;
;
点评 本题考查氯气的制备和性质实验,题目难度中等,注意萃取分液的原理应用.


 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:选择题
| A. | 0.2 mol•L-1 | B. | 0.4 mol•L-1 | C. | 0.6 mol•L-1 | D. | 0.8 mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
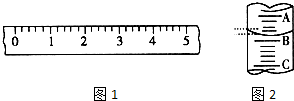 (1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在下表中填空,表示称量过程,并在图1所示的游码尺上画出游码的位置(画“|”表示).
(1)某学生用托盘天平称量一个小烧杯的质量,如小烧杯的质量为32.6g,用“↓”表示在托盘上放砝码,“↑”表示从托盘上取砝码,请用箭头在下表中填空,表示称量过程,并在图1所示的游码尺上画出游码的位置(画“|”表示).| 砝码质量/g | 50 | 20 | 20 | 10 | 5 |
| 取用砝码情况 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.025 mol | B. | 0.050 mol | C. | 0.100 mol | D. | 0.200 mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 草酸与酸性高锰酸钾溶液反应:2MnO4-+5H2C2O4+6H+═2Mn2++10CO2↑+8H2O | |
| B. | 硫代硫酸钠与硫酸的离子方程式:S2O32-+2H+═SO2↑+S↓+H2O | |
| C. | KI溶液中滴加稀硫酸,敞口放置:2H++2I-+O2═I2+2H2O | |
| D. | K2Cr2O7的溶液中存在的平衡体系:Cr2O72-+H2O?2CrO42-+2H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 平衡前,充入氮气,容器内压强增大,反应速率加快 | |
| B. | 平衡时,其他条件不变,分离出硫,逆反应速率减小 | |
| C. | 平衡时,其他条件不变,升高温度可提高 SO2 的转化率 | |
| D. | 其他条件不变,缩小容器体积,平衡正反应方向移动,该反应的平衡常数不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 结合Na、Al、Fe的有关性质,回答下列问题.
结合Na、Al、Fe的有关性质,回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com