
【题目】根据问题填空:
(1)已知下列两个热化学方程式: C3H8(g)+5O2(g)=3CO2(g)+4H2O(l)△H=﹣2220.0kJmol﹣1
H2O(l)=H2O(g)△H=+44.0kJmol﹣1则0.5mol C3H8燃烧生成CO2和气态水时释放的热量为kJ.
(2)已知:①CO(g)+ ![]() O2(g)=CO2(g)△H=﹣283.0kJmol﹣1②CH3OH(l)+
O2(g)=CO2(g)△H=﹣283.0kJmol﹣1②CH3OH(l)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=﹣726.5kJmol﹣1
O2(g)=CO2(g)+2H2O(l)△H=﹣726.5kJmol﹣1
请写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式: .
(3)科学家已获得了极具理论研究意义的N4分子,其结构为正四面体(如图所示),与白磷分子相似.已知断裂1molN﹣N键吸收193kJ热量,断裂1molN≡N键吸收941kJ热量,则1molN4气体转化为2molN2时的△H= . (填﹣724kJmol﹣1或+724kJmol﹣1) 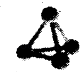
【答案】
(1)1022
(2)CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=﹣443.5kJ?mol﹣1
(3)﹣724kJ mol﹣1
【解析】解:(1)已知:①C3H8(g)+5O2(g)═3CO2(g)+4H2O(l)△H=﹣2220.0kJmol﹣1
②H2O(l)═H2O(g)△H=+44.0kJmol﹣1
根据盖斯定律①+②×4可得丙烷燃烧生成CO2和气态水的反应为:C3H8(g)+5O2(g)═3CO2(g)+4H2O(g),△H=﹣2220.0kJmol﹣1+4×44.0kJmol﹣1=2044kJmol﹣1,
所以0.5mol丙烷燃烧生成CO2和气态水时释放的热量为:2044kJ/mol×0.5mol=1022kJ,
所以答案是:1022;(2)①CO(g)+ ![]() O2(g)=CO2(g)△H=﹣283.0kJmol﹣1
O2(g)=CO2(g)△H=﹣283.0kJmol﹣1
②CH3OH(l)+ ![]() O2(g)=CO2(g)+2H2O(l)△H=﹣726.5kJmol﹣1
O2(g)=CO2(g)+2H2O(l)△H=﹣726.5kJmol﹣1
依据盖斯定律②﹣①得到甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式为:CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=﹣443.5kJmol﹣1 ;
所以答案是:CH3OH(l)+O2(g)═CO(g)+2H2O(l)△H=﹣443.5kJmol﹣1 ;(3)从结构图中可看出,一个N4分子中含有6个N﹣N键,根据反应热等于反应物的总键能减生成物的总键能,则N4(g)=2N2(g)△H,有△H=6×193 kJmol﹣1﹣2×941 kJmol﹣1=﹣724 kJmol﹣1,
所以答案是:﹣724kJ mol﹣1.


科目:高中化学 来源: 题型:
【题目】298K时,某种甲酸(HCOOH)和甲酸钠的混合溶液中HCOOH、HCOO-的浓度存在关系式c(HCOO-)+c(HCOOH)=0.100mol·L-1,含碳元素的粒子的浓度与pH的关系如图所示。下列说法正确的是( )

A. 298K时,HCOOH的电离常数Ka=1.0×10-10.25
B. 0.1mol·L-1HCOONa溶液中有c(HCOO-)+c(HCOOH)+c(OH-)<c(H+)+0.1
C. 298K时,加蒸馏水稀释P点溶液,溶液中n(H+)·n(OH-)增大
D. 0.1mol·L-1HCOONa溶液和0.1mol·L-1HCOOH溶液等体积混合后,溶液的pH=3.75(混合后溶液体积变化忽略不计)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )
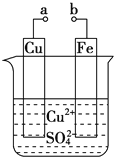
A. a和b不连接时,铁片上会有金属铜析出
B. a和b用导线连接时,铜片上发生的反应为:Cu2++2e-=Cu
C. 无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D. a和b用导线连接时,Fe片上发生还原反应,溶液中SO42-向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如下图所示的装置中,观察到电流计指针偏转,M棒变粗,N棒变细,并测得电解质溶液的质量减小,由此判断下表中所列M、N、P物质,其中可以成立的是( )
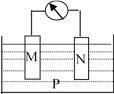
M | N | P | |
A | Zn | Cu | 稀硫酸溶液 |
B | Cu | Fe | 稀盐酸 |
C | Ag | Zn | 硝酸银溶液 |
D | Zn | Fe | 硫酸亚铁溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将NaHCO3和Na2O2按物质的量3:1混合,在密闭容器中充分混合加热后,最后排出气体,残留的固体是( )
A. NaOH和Na2CO3 B. Na2CO3 C. Na2O2和Na2CO3 D. Na2O2和Na2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向10 mL 0.40 mol·L-1 H2O2溶液中加入适量FeCl3溶液,不同时刻测得生成O2的体积(已折算为标准状况)如下表所示。
t / min | 0 | 2 | 4 | 6 |
V(O2) / mL | 0 | 9.9 | 17.2 | 22.4 |
资料显示,反应分两步进行:
①2Fe3++ H2O2 ![]() 2Fe2++O2↑+2H+
2Fe2++O2↑+2H+
② H2O2 + 2Fe2++2H+ ![]() 2H2O+2Fe3+
2H2O+2Fe3+
反应过程中能量变化如右图所示。下列说法不正确的是

A. 0~6 min的平均反应速率:v(H2O2) = 3.33×10-2 mol·L-1·min-1
B. Fe3+的作用是加快过氧化氢的分解速率
C. 反应①是吸热反应、反应②是放热反应
D. 反应2H2O2(aq)![]() 2H2O(l) + O2(g)的△H =E1-E2 < 0
2H2O(l) + O2(g)的△H =E1-E2 < 0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】北京时间11月1日清晨5时58分07秒,中国“长征二号F”遥八运载火箭在酒泉卫星发射中心载人航天发射场点火发射,火箭的第三级使用的推进剂是液氢和液氧。
已知下面在298K时的热化学方程式:
2H2(g)+O2(g)== 2H2O(l) ΔH=-571.6 kJ·mol-1
CH4(g)+2O2(g)==CO2(g)+2H2O (l)ΔH=-890.3 kJ·mol-1
C(s)+O2(g)== CO2(g)ΔH=-393.5 kJ·mol-1
根据上面的热化学方程式完成下列问题:
(1)通过计算说明等质量的H2、C、CH4完全燃烧时放出热量最多的是_________。
(2)根据以上反应,则C(s)+2H2(g)== CH4(g)的焓变ΔH=________________。
(3)已知H2O(l)== H2O(g) ΔH=+44.0 kJ·mol-1
试写出甲烷燃烧生成二氧化碳和水蒸气的热化学方程式:________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某试液中只可能含有K+、NH4+、Fe2+、A13+、Cl-、SO42-、CO32-、A1O2-中的若干种离子,离子浓度均为0.1mol/L,某同学进行了如下实验: 下列说法正确的是
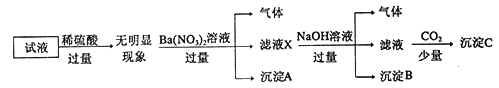
A. 原溶液中存在NH4+、Fe2+、Cl-、SO42-
B. 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+
C. 无法确定沉淀C的成分
D. 无法确定原试液中是否含有Al3+、Cl-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com