
【题目】在如图所示的串联装置中,发现灯泡不亮,但若向其中一个烧杯加水,则灯泡会亮起来:
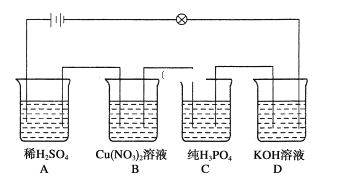
则:(1)加水的烧杯为__________。
(2)写出下列离子方程式:
硝酸铜溶液与氢氧化钾溶液混合_________,稀硫酸溶液与碳酸钠溶液混合_________
(3)若在A烧杯中加入Ba(OH)2溶液后,溶液的导电性________。(填“变强”“变弱”“不变”)
【答案】C Cu2++2OH-=Cu(OH)2↓ 2H++CO32-=H2O+CO2↑ 变弱
【解析】
(1).纯磷酸是不导电的,向磷酸中加入水形成的磷酸溶液可以电离,才能导电,故加水的烧杯为C,
故答案为:C;
(2).硝酸铜溶液与氢氧化钾溶液混合,属于盐和碱发生的复分解反应,故化学方程式为Cu(NO3)2+2KOH= Cu(OH)2↓+2KNO3,离子反应为Cu2++2OH-=Cu(OH)2↓;稀硫酸溶液与碳酸钠溶液混合,属于盐和酸的复分解反应,H2SO4+Na2CO3= Na2SO4+ H2O+CO2↑,离子反应为2H++CO32-=H2O+CO2↑,
故答案为Cu2++2OH-=Cu(OH)2↓;2H++CO32-=H2O+CO2↑;
(3)A烧杯中是硫酸,是强电解质,加入Ba(OH)2溶液后,发生反应H2SO4 +Ba(OH)2= BaSO4↓+ 2H2O,生成了BaSO4,它属于难溶物,溶液中离子的浓度在减小,故溶液的导电性会变弱,
故答案为:变弱。


科目:高中化学 来源: 题型:
【题目】关于下列化工生产流程的说法不正确的是
①铁矿石、焦炭、石灰石、空气、生铁
②黄铜矿![]() Cu2S
Cu2S![]() Cu(粗)
Cu(粗)![]() Cu(精)
Cu(精)
③石英![]() Si(粗)
Si(粗)![]() SiCl4
SiCl4![]() Si(高纯)
Si(高纯)
④![]()
A. ①的主要设备是炼铁高炉,生产过程中产生的高炉煤气主要成分是![]() 等,形成的炉渣中某成分可用作生产普通玻璃
等,形成的炉渣中某成分可用作生产普通玻璃
B. ②中电解精炼铜时,粗铜中的杂质全部沉积在阳极区,由![]() 组成的电解液需循环更换
组成的电解液需循环更换
C. ③中粗硅与![]() 反应后,可用分馏的方法提纯
反应后,可用分馏的方法提纯![]()
D. ④中Ⅰ、IV两步转化后的气体均需循环以提高原料的利用率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】运用已学知识完成下列计算:
(1)17gNH3共有___mol原子,0.1molH2S共有___个氢原子;同质量的NH3和H2S中分子个数比为___。
(2)现有mg某气体,它由双原子分子构成,它的摩尔质量为Mg·mol-1。若阿伏加德罗常数用NA表示,则该气体的物质的量为___mol,该气体所含原子总数为___个,在标准状况下该气体的体积为____L,若该气体不与水反应,将其溶于1L水(密度为1g·cm-3)中,所得溶液中溶质的质量分数为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去粗盐中的杂质 CaCl2、MgCl2 和 Na2SO4,过程如下:
![]()
下列有关说法中,不正确的是( )
A. 除去 Mg2+的主要反应: Mg2++ 2OH-=Mg(OH)2↓
B. 试剂①一定不是Na2CO3溶液
C. 检验 SO42-是否除净:取少量滤液,加稀盐酸酸化,再加 BaCl2 溶液
D. 滤液加稀盐酸时只发生反应:H+ +OH- =H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钴及其化合物广泛应用于磁性材料、电池材料及超硬材料等领域。
(1)CoxNi(1-x)Fe2O4(其中Co、Ni均为+2)可用作H2O2分解的催化剂,具有较高的活性。
①该催化剂中铁元素的化合价为______。
②图1表示两种不同方法制得的催化剂CoxNi(1-x)Fe2O4在10℃时催化分解6%的H2O2溶液的相对初始速率随x变化曲线。由图中信息可知:______________法制取得到的催化剂活性更高;Co2+、Ni2+两种离子中催化效果更好的是______。
(2)草酸钴是制备钴的氧化物的重要原料。下图2为二水合草酸钴(CoC2O4·2H2O)在空气中受热的质量变化曲线,曲线中300℃及以上所得固体均为钴氧化物。
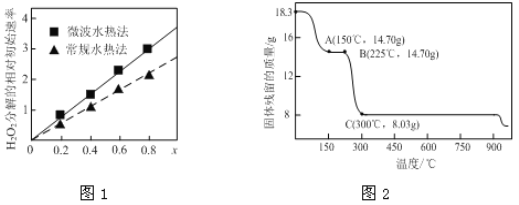
①通过计算确定A点剩余固体的化学成分为________________(填化学式)。试写出B点对应的物质与O2在225℃~300℃发生反应的化学方程式:_________________________________________。
②取一定质量的二水合草酸钴分解后的钴氧化物(其中Co的化合价为+2、+3),用480 mL 5 mol/L盐酸恰好完全溶解固体,得到CoCl2溶液和4.48 L(标准状况)黄绿色气体。试确定该钴氧化物中Co、O的物质的量之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以丁烯二醛和肼为原料经过DielsAlder反应合成哒嗪,合成关系如图:
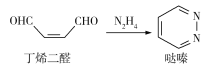
下列说法正确的是
A. 哒嗪与氢气加成后的产物分子式为C4H6N2
B. 聚丁烯二醛因无碳碳双键不能使溴水褪色
C. 丁烯二醛与N2H4可以在一定条件下加成后再消去可制得哒嗪
D. 物质的量相等的丁烯二醛和哒嗪分别与氢气完全加成,消耗氢气的量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.22.4LCO和CO2的混合气体中所含的碳原子数一定是NA
B.常温常压下,32gO2和32gO3所含氧原子数都是NA
C.48gO2所含的分子数为3NA
D.标准状况下36 g H2O中原子的数目为6NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2FeO4是一种集氧化、吸附、絮凝、消毒、杀菌、除臭等功能于一体的绿色高效水处理剂,已成为多个领域不可短缺的物质之一,工业制备工艺如图所示,回答下列问题:

(1)在湿法制备Na2FeO4工艺中,请写出氯碱工业过程中用惰性电极电解饱和NaCl溶液的离子方程式:___;NaClO与FeCl3在碱性条件下制备Na2FeO4的反应中被氧化的原子与被还原的原子个数比为____;可循环使用的物质为___(任写一种)。
(2)电解法制备Na2FeO4工艺中,阳极材料为铁平板,在使用前要经过粗砂和细砂打磨抛光,其目的为____;钛合金材料作阴极,电解质溶液为NaOH溶液,请写出阳极电极反应式:____。
(3)干法制备Na2FeO4工艺是最早发现的制备工艺,请写出NaClO固体、Fe(NO3)3·9H2O晶体、NaOH固体在高温熔融的条件下制备Na2FeO4的化学方程式:_____。
(4)请写出由Na2FeO4制备K2FeO4的化学方程式:____;请说明该反应能发生的原因:____。
(5)粗K2FeO4提纯时用-5℃饱和KOH的原因____;K2FeO4是绿色水处理剂,能对水起到杀菌、消毒,又能起到净水的作用,其原因为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据所给条件推出的结论不正确的是( )
选项 | 条件 | 结论 |
A | 在水溶液或熔融状态下可以导电的化合物,称为电解质 | 水中存在: |
B | 凡是能给出质子的分子或离子称为酸,凡是能接受质子的分子或离子称为碱 |
|
C | 联氨为二元弱碱,在水中的电离方式与氨相似 | 联氨与硫酸形成的酸式盐的化学式为: |
D | 发生化学反应时,接受电子对的物质为酸,提供电子对的物质为碱 |
|
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com