
【题目】常温下,在20mL0.lmol/LNa2CO3溶液中逐滴加入40mL0.l mol/L 稀盐酸,溶液中含碳元素各种微粒(CO2因逸出未画出)的物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。下列说法正确的是

A.曲线a表示H2CO3的变化曲线
B.H2CO3、HCO3-、CO32-可大量共存于同一溶液中
C.pH=11时,c(HCO3-)>c(Cl-)
D.碳酸钠溶液的水解平衡常数为1.0×10-11
 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案科目:高中化学 来源: 题型:
【题目】草酸钴可用于指示剂和催化剂的制备。用水钴矿(主要成分为Co2O3,含少量Fe2O3、A12O3、MnO、MgO、CaO、SiO2等)制取CoC2O4·2H2O工艺流程如下:

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Ca2+、Mg2+、Al3+等; ②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
沉淀物 | Fe(OH)3 | Al(OH)3 | Co(OH)2 | Fe(OH)2 | Mn(OH)2 |
完全沉淀的pH | 3.7 | 5.2 | 9.2 | 9.6 | 9.8 |
(1)写出浸出过程中Na2SO3与Co2O3发生反应的离子方程式:______________。
(2)浸出液中加入NaClO3的目的是____________________________。
(3)加Na2CO3能使浸出液中某些金属离子转化成氢氧化物沉淀,沉淀除Al(OH)3外,还有的成分是_____(填化学式)。
(4)萃取剂对金属离子的萃取率与pH的关系如图,萃取剂的作用是______;其使用的适宜pH范围是___。

A.2.02.5 B.3.03.5 C.4.04.5
(5)滤液I“除钙、镁”是将其转化为MgF2、CaF2沉淀。己知Ksp(MgF2)=7.35×10-11、Ksp(CaF2)=1.05×10-10,当加入过量 NaF后,所得滤液 c(Mg2+)/c(Ca2+) =____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】吡洛芬是一种用于治疗风湿病的药物。它的合成路线如下:

已知:
①![]() (易被氧化)
(易被氧化)
②![]() +RCH2X
+RCH2X![]() +NaX
+NaX
回答下列问题:
(1)B→C的反应类型为______________________________。
(2)A→B的化学方程式为___________________________________________________。
(3)从整个合成路线看,步骤A→B的目的是__________________________________________________。
(4)E的结构简式为____________________________。
(5)非那西汀是一种解热药,其结构简式为![]() 。写出以苯酚钠、CH3CH2OH和(CH3CO)2O为原料制备非那西汀的合成路线流程图(无机试剂任用)__________________________。
。写出以苯酚钠、CH3CH2OH和(CH3CO)2O为原料制备非那西汀的合成路线流程图(无机试剂任用)__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸异戊酯G( )是一种香料,一种合成路线如下:
)是一种香料,一种合成路线如下:

已知以下信息:
①RCHO+![]()
![]()
 +H2O
+H2O
②C为甲醛的同系物,相同条件下其蒸气与氢气的密度比为22。
回答下列问题:
(1)A转化为B的化学方程式为________。
(2)B和C反应生成D的化学方程式为________。
(3)F的结构简式为________,名称为________。
(4)D与新制Cu(OH)2悬浊液反应的化学方程式为________。
(5)F的同分异构体中不能与金属钠反应生成氢气、核磁共振氢谱只有两组峰、且峰面积比为3∶1的为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为减轻大气污染,必须要加强对工业废气和汽车尾气的治理,根据所学知识回答下列问题:
(1)化石燃料包括煤、石油和___。
(2)酸雨是指pH___(填“>”“<”或“=”)5.6的降水,煤的燃烧是导致酸雨形成的主要原因,而正常雨水的pH约为5.6,原因是___(用化学方程式表示)。
(3)在汽车尾气排放口加装“三效催化净化器”,在不消耗其他物质的情况下,可将尾气中的一氧化碳、一氧化氮转化为参与大气循环的气体和无毒的气体,该反应的化学方程式为___。
(4)在新能源汽车未普及时,如图所示为一种“节能减排”的有效措施,以下对乙醇做汽车燃料的描述错误的是____(填字母,下同)。

A.原料来源丰富 B.是可再生能源 C.燃烧完全没有污染
(5)Cu与稀HNO3反应的离子方程式为:___。
(6)工业上将氯气通入石灰乳制取漂白粉,漂白粉的有效成分是___。
(7)用氢氧化钠溶液可以吸收废气中的氮氧化物,反应的化学方程式如下:NO2+NO+2NaOH=2NaNO2+H2O、2NO2+2NaOH=NaNO2+NaNO3+H2O。现有VL某NaOH溶液能完全吸收nmolNO2和mmolNO组成的大气污染物。
①所用烧碱溶液的物质的量浓度至少为____mol·L-1。
②若所得溶液中c(NO3-)∶c(NO2-)=1∶9,则原混合气体中NO2和NO的物质的量之比n∶m=____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物M可从酸牛奶中提取。已知纯净的M为无色黏稠液体, 易溶于水。为研究M的组成与结构,进行了如下实验:
实验步骤 | 解释或实验结论 |
(1)称取4.5 g M,升温使其汽化,测其密度是相同条件下H2的45倍。 | 试通过计算填空:(1)M的摩尔质量为:____ 。 |
(2)将此4.5 g M 在足量纯 O2中充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现两者分别增重2.7g和6.6 g | (2)M的分子式为:____。 |
(3)1摩尔M 能与足量Na产生1molH2,或与足量NaHCO3产生1molCO2 | (3)写出M中含有的官能团结构简式____ |
(4)M 的核磁共振氢谱如下图:
| (4)M 中含有____种氢原子。 |
(5)综上所述,M 的结构简式为____。 | |
(6)写出两分子M聚合成环状化合物的化学方程式____ | |
(7)写出M发生消去反应的方程式____ | |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将15.2 g 铜和镁组成的混合物加入250 mL4.0molL-1的稀硝酸中,固体完全溶解,生成的气体只有NO。向所得溶液中加入1.0L NaOH溶液,此时金属离子恰好沉淀完全,沉淀质量为25.4 g,下列说法正确的是
A.原固体混合物中,Cu和Mg的物质的量之比为1:2
B.氢氧化钠溶液的浓度为0.8 mol·L-1
C.固体溶解后的溶液中硝酸的物质的量为0.1mol
D.生成的NO气体在标况下的体积为2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学拟用A、C两种有机物合成F(苯乙酸乙酯),合成的路线如图所示:
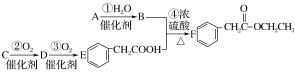
已知:A为最简单的烯烃,C为烃的衍生物,D中含有—CHO。
(1)请写出C的结构简式:________________。
(2)请写出①④的反应类型:①_______________④______________。
(3)请分别写出C、E中官能团的名称:C___________E__________。
(4)写出反应②④的化学方程式:
②__________;
④_________。
(5)J是有机物A的同系物,且比A多1个碳原子,J的加聚产物的结构简式______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室需要用480mL0.1molL-1的硫酸铜溶液,以下配制方法正确的是( )
A. 称取![]() 胆矾(CuSO4·5H2O),配成500mL溶液
胆矾(CuSO4·5H2O),配成500mL溶液
B. 称取![]() 胆矾(CuSO4·5H2O),加入500mL水配成溶液
胆矾(CuSO4·5H2O),加入500mL水配成溶液
C. 称取![]() 无水硫酸铜粉末,加入480mL水配成溶液
无水硫酸铜粉末,加入480mL水配成溶液
D. 称取![]() 无水硫酸铜粉末,加入500mL水配成溶液
无水硫酸铜粉末,加入500mL水配成溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com