
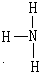 ����������ˮ����һˮ�ϰ���һˮ�ϰ�Ϊ�����ˮ�е����笠�������������NH3+H2O?NH3?H2O?NH4++OH-���ʴ�Ϊ��
����������ˮ����һˮ�ϰ���һˮ�ϰ�Ϊ�����ˮ�е����笠�������������NH3+H2O?NH3?H2O?NH4++OH-���ʴ�Ϊ��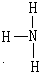 ��NH3+H2O?NH3?H2O?NH4++OH-��
��NH3+H2O?NH3?H2O?NH4++OH-��


| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A����0.5mol H |
| B����1��ˮ���� |
| C��Լ��6.02��1023 ����ԭ�� |
| D��Լ��3.01��1023 ��ˮ���� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A���٢ڢ� | B���٢ۢ� |
| C���ܢݢ� | D���٢ڢ� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| �� |
| t/min | 0 | 5 | 10 |
| AO/mol?L��1 | 1.00 | 0.65 | 0.50 |
| H2/mol?L��1 | 2.00 | 1.00 | |
| AH3OH/mol?L��1 | 0.00 | 0.35 | 0.50 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
A�� |
B�� |
C�� |
D�� |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
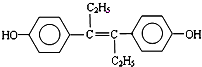
| A��M���ڷ����廯���� |
| B��M����NaOH��Һ��NaHCO3��Һ������Ӧ |
| C��1molM�������7molH2�����ӳɷ�Ӧ |
| D��1molM�뱥����ˮ��ϣ��������5molBr2 |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| A�������������[��NH4��2Fe��SO4��2?6H2O]��ϡ��Һ����μ�������Ba��OH��2ϡ��Һ��NH4++Fe2++SO42-+Ba2++3OH-=BaSO4��+Fe��OH��2��+NH3?H2O | ||||
| B����������ͨ���Ȼ�����Һ��SO2+2Fe3++4H+=SO42-+2Fe2++2H2O | ||||
| C��H218O2�м������Ը��������Һ��5H218O2+2MnO4-+6H+=2Mn2++518O2��+8H2O | ||||
D���ö��Ե缫����Ȼ�þ��Һ��2Cl-+2H2O
|
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com