
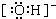
分析 (1)根据价层电子对互斥理论确定离子空间构型及原子杂化方式;
(2)根据元素符号,判断元素原子的核外电子数,再根据构造原理来写;氢氧根离子中氢原子与氧原子间共用1对电子;
(3)同周期自左而右元素第一电离能呈增大趋势,但N元素原子的2p能级含有3个电子,处于半满稳定状态,能量较低,失去第1个电子需要的能量较大;
(4)根据等电子体是指具有相同电子数目和原子数目的分子或离子来回答;
(5)碳原子的成键情况主要根据与碳原子形成共价键的原子的数目确定.
解答 解:(1)NH3的中心原子N的价层电子对个数=3+$\frac{1}{2}$×(5+-3×1)=4,价层电子对数为4,而且含有1个孤电子对,所以其空间构型三角锥形;
故答案为:三角锥;
(2)Fe元素为26号元素,原子核外有26个电子,所以核外电子排布式为:1s22s22p63s23p63d64s2,Fe失去三个电子得到Fe3+,Fe3+的电子排布式为1s22s22p63s23p63d5;所以基态Fe3+的价电子排布式为3d5;氢氧根离子中氢原子与氧原子间共用1对电子,其电子式为 ;
;
故答案为:3d5; ;
;
(3)同周期自左而右第一电离能呈增大趋势,N元素原子的2p能级有3个电子,为半满稳定状态,能量降低,失去第一个电子需要的能量较高,第一电离能高于同周期相邻元素,故第一电离能N>O>C,
故答案为:N>O>C;
(4)CNO-中电子数为:6+7+8+1=22,与CO2具有相同电子数目和原子数目,是等电子体,常见粒子还有CO2(或N2O、CS2等)等;
故答案为:CO2(或N2O、CS2等);
(5)HCN分子中有1个碳原子和1个氮原子,1个氢原子,碳是中心原子,采用sp2杂化,碳与氢形成单键,与氮形成三键,则结构式为H-C≡N,
故答案为:H-C≡N.
点评 本题考查了价层电子对互斥理论的应用、电子排布式、电子式、第一电离能、等电子体、结构式等,题目涉及的知识点较多,侧重于考查学生对基础知识的综合应用能力,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 石油、天然气等燃烧产生大量二氧化碳 | |
| B. | 大量燃烧含硫量高的煤产生二氧化硫 | |
| C. | 森林遭到乱砍烂伐,破坏了生态环境 | |
| D. | 各种机动车排放的尾气 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 在外电路中,电子由银电极流向铜电极 | |
| B. | 取出盐桥后,电流计的指针仍发生偏转 | |
| C. | 外电路中每通过0.1 mol电子,铜的质量理论上减小6.4 g | |
| D. | 原电池的总反应式为Cu+2AgNO3=2Ag+Cu(NO3)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
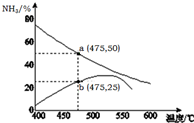 氨是一种重要的化工原料,也是重要的工业产品,在工农业生产和国防等领域发挥着重要作用.
氨是一种重要的化工原料,也是重要的工业产品,在工农业生产和国防等领域发挥着重要作用.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 既能与酸又能与碱反应的物质一定是两性氧化物或两性氢氧化物 | |
| B. | 往Fe(OH)3胶体中逐滴加入稀H2SO4溶液时,开始时会出现沉淀,再继续滴加时,沉淀又会消失 | |
| C. | 胶体区别于其他分散系的本质特征是丁达尔现象 | |
| D. | 某物质溶于水后所得溶液能导电,该物质一定属于电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1mol•L-1氨水中加入少量水,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$减少 | |
| B. | 将NH4Cl溶液从20℃升温至30℃,溶液中$\frac{c(N{H}_{4})}{c(N{H}_{3}•{H}_{2}O)•c({H}^{+})}$增大 | |
| C. | 向氢氧化钠溶液中加入醋酸至中性,溶液中$\frac{c(C{H}_{3}COO)}{c(N{a}^{+})}$=1 | |
| D. | 向含有BaSO4、BaCO3的饱和溶液中加入少量的Ba(NO3)2,溶液中的$\frac{c(S{O}_{4}^{2-})}{c(C{O}_{3}^{2-})}$减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 实验编号 | HA物质的量浓度(mol•L-1) | NaOH物质的量浓度(mol•L-1) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
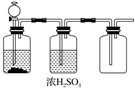
| A. | FeS和稀H2SO4 | B. | 加热NaCl和浓H2SO4制HCl | ||
| C. | 大理石和稀盐酸 | D. | MnO2和浓盐酸 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com